题目内容
4.把下列四种X溶液分别加进4个均盛有10mL2mol/L盐酸的烧杯中,并立即都加入水稀释至50mL,此时X和盐酸进行反应,其中反应速率最快的是( )| A. | 20mL,2.5mol/L | B. | 30mL,2mol/L | C. | 10ml,5mol/L | D. | 20mL,2mol/L |
分析 先计算出稀释后X溶液的中X的物质的量,最后溶液的体积都为50mL,则物质的量越大,浓度越大,则反应速率越大.
解答 解:A、20mL,2.5mol/L的X溶液,X的物质的量为0.02L×2.5mol/L=0.05mol;
B、30mL2mol/L的X溶液,X的物质的量为0.03L×2mol/L=0.06mol;
C、10mL5mol/L的X溶液,X的物质的量为0.01L×5mol/L=0.05mol;
D、20mL2mol/L的X溶液,X的物质的量为0.02L×2mol/L=0.04mol,
显然四种情况下B中浓度最大,所以反应速率是最大.
故选B.
点评 本题考查反应速率与浓度的关系及物质的量的计算,明确影响化学反应速率的因素,物质的量与浓度的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
14.在体积一定的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g)其化学平衡常数K和温度t的关系如表,回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选不得分).
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)某温度下SO2的转化反应的2SO2(g)+O2(g)?2SO3(g)平衡常数K=532.4.
下面三个混合体系中各物质的浓度如下表:
试判断各体系反应进行的方向:体系(2)正向;体系(2):已平衡(填正向、逆向或已平衡).
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选不得分).
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)某温度下SO2的转化反应的2SO2(g)+O2(g)?2SO3(g)平衡常数K=532.4.
下面三个混合体系中各物质的浓度如下表:
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 浓度商 |
| (1) | 0.0600 | 0.400 | 2.000 | 不填 |
| (2) | 0.0960 | 0.300 | 0.500 | 不填 |
| (3) | 0.0862 | 0.263 | 1.020 | 不填 |
15.下列离子方程式书写正确的是( )
| A. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯气和水反应:Cl2+H2O═Cl-+ClO-+2H+ | |
| C. | 碳酸钡与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氯气和石灰乳反应:Ca(OH)2+Cl2═Ca2++Cl-+ClO-+H2O |
9.短周期元素X、Y、Z在元素周期表中的位置如图所示,其中Y元素原子的最外层电子数是电子层数的两倍.回答下列问题:
(1)Z元素在元素周期表中的位置是第三周期第VIA族.
(2)下列能证明Y元素与Z元素的得电子能力强弱的是BC.(填序号)
A.氢化物水溶液的酸性 B.最高价氧化物对应的水化物的酸性
C.气态氢化物的稳定性 D.与金属化合时每个原子得电子的多少
(3)比较Y和Z简单离子半径大小(用离子符号表示)S2->Cl-
(4)X元素的某种气态氢化物分子中含有10个电子.该物质在加热条件下能够将CuO还原为Cu,同时生成一种气体,该气体是空气中的成分之一.则反应的化学方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2.若反应中有6.02×1022个电子发生转移,则有4g的CuO参加反应.
| X | ||
| Y | Z |
(2)下列能证明Y元素与Z元素的得电子能力强弱的是BC.(填序号)
A.氢化物水溶液的酸性 B.最高价氧化物对应的水化物的酸性
C.气态氢化物的稳定性 D.与金属化合时每个原子得电子的多少
(3)比较Y和Z简单离子半径大小(用离子符号表示)S2->Cl-
(4)X元素的某种气态氢化物分子中含有10个电子.该物质在加热条件下能够将CuO还原为Cu,同时生成一种气体,该气体是空气中的成分之一.则反应的化学方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2.若反应中有6.02×1022个电子发生转移,则有4g的CuO参加反应.
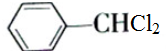 ,沸点206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图所示.
,沸点206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图所示.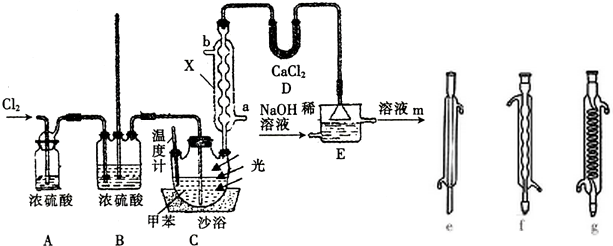
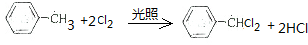 .
.