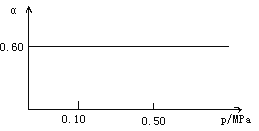
题目内容
【题目】按要求完成下列各题。
(1)FeCl3溶液中加入KSCN呈红色,写出离子方程式_________________________。
(2)NaHCO3溶液显碱性的原因_________________________。
(3)NH4Cl溶液加入锌粒产生气体的离子方程式_________________________。
(4)已知16克固体硫充分燃烧放出148.4kJ的热量,则该反应的热化学方程式为_____________。
【答案】 Fe3++3SCN-![]() Fe(SCN)3 HCO3-+H2O
Fe(SCN)3 HCO3-+H2O![]() H2CO3+OH- 2NH4++Zn=2NH3↑+H2↑+Zn2+ S(s)+O2(g)=SO2(g) ΔH=-296.8kJ/mol
H2CO3+OH- 2NH4++Zn=2NH3↑+H2↑+Zn2+ S(s)+O2(g)=SO2(g) ΔH=-296.8kJ/mol
【解析】(1)FeCl3溶液中加入KSCN呈红色,反应的离子方程式为Fe3++3SCN-![]() Fe(SCN)3,故答案为:Fe3++3SCN-
Fe(SCN)3,故答案为:Fe3++3SCN-![]() Fe(SCN)3;
Fe(SCN)3;
(2)碳酸氢根离子在水溶液里电离程度小于水解程度而导致溶液呈碱性,水解的方程式为HCO3-+H2O![]() H2CO3+OH-,故答案为:HCO3-+H2O
H2CO3+OH-,故答案为:HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
(3)NH4Cl溶液水解显酸性,加入锌粒生成氢气,同时促进铵根离子水解放出氨气,反应的离子方程式为2NH4++Zn=2NH 3↑+H2↑+Zn2+,故答案为:2NH4++Zn=2NH 3↑+H2↑+Zn2+;
(4)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出296.8kJ热量,则热化学方程式为:S(s)+O2(g)=SO2(g);△H=-296.8kJ/mol,故答案为:S(s)+O2(g)=SO2(g);△H=-296.8kJ/mol。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572KJ的热量,则表示H2的燃烧热的热化学方程式为_________
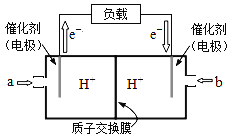
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图放电时甲醇应从____处通入(填“a”或“b”).电池内部H+向______(填“左”或“右”)移动。写出电池负极的电极反应式_____。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.已知:N2(g)+3H2(g)=2NH3(g)ΔH=-93kJ/mol,试根据表中所列键能数据计算a的数值__________。
化学键 | H-H | N-H | N≡N |
键能/kJmol | 436 | a | 945 |
当可逆反应中净生成N-H物质的量为2mol时,反应放热________
(4) 已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJmol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJmol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJmol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=___.