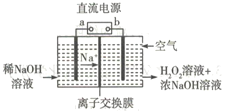
题目内容
【题目】已知250C时,醋酸溶液中电离平衡常数为k= ×10-5,回答下列问题:
×10-5,回答下列问题:
(1)向溶液中加入少量盐酸,电离平衡______移动,K值________(填“增大” “不变”“减小”)。
(2)若醋酸的起始浓度为0.010mol/L,则平衡时c(H+)=____________________(提示:平衡时的醋酸浓度可近似看为0.010mol/L)。
(3)(2)问中的醋酸电离度为_____________(电离度即醋酸的电离平衡转化率)。
【答案】 逆向 不变 4.18×10-4mol/L 4.18%
【解析】(1)向醋酸溶液中加入盐酸,抑制醋酸的电离,但电离平衡常数不变,因为电离平衡常数只与温度有关,温度不变,醋酸的电离平衡常数不变,故答案为:逆向;不变;
(2)c(H+)=![]() =
=![]() mol/L=4.18×10-4mol/L,故答案为:4.18×10-4mol/L;
mol/L=4.18×10-4mol/L,故答案为:4.18×10-4mol/L;
(3)c(H+)= c(CH3COO-)=4.18×10-4mol/L,则醋酸电离度=![]() ×100%=4.18%,故答案为:4.18%。
×100%=4.18%,故答案为:4.18%。

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
【题目】下列除去括号内杂质的有关操作方法正确的是
物质(杂质) | 操作方法 | |
A | 苯(硝基苯) | 加少量蒸馏水,分液 |
B | 乙醇(水) | 加新制的生石灰,蒸馏 |
C | CO2(HCl) | NaOH溶液,洗气 |
D | 乙烷(乙烯) | 酸性KMnO4溶液,洗气 |
A. A B. B C. C D. D