题目内容
【题目】数十亿年来,地球上的物质不断地发生变化,大气的成分也发生了很大变化。下表是原始大气和目前空气的成分:
空气的成分 | N2、O2、CO2、水蒸气及稀有气体He、Ne等 |
原始大气 的成分 | CH4、NH3、CO、CO2等 |
用上表所涉及的分子填写下列空白。
(1)含有10个电子的化学式有(填化学式,下同)________。
(2)由极性键构成的非极性分子有________。
(3)与H+可直接形成配位键的分子有________。
(4)分子中不含孤电子对的分子(除稀有气体外)有_______,它的立体构型为______。
(5)CO的结构可表示为O![]() C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
【答案】(1)H2O、Ne、CH4、NH3
(2)CH4、CO2(3)NH3、H2O
(4)CH4 正四面体形
(5)N2 不相同 配位键
【解析】(1)10e-分子可以用氖(Ne)作为标准,依次找出与氖同周期的元素与氢形成的化合物,有HF、H2O、NH3、CH4,题干要求用表中分子填空,不应填写HF。
(2)由极性键构成的非极性分子应是含有极性键且分子有对称结构的,应是CH4和CO2。
(3)H+有空轨道,与它形成配位键的分子应有孤电子对,据![]() 知,NH3和H2O可以和H+以配位键结合分别形成NH
知,NH3和H2O可以和H+以配位键结合分别形成NH![]() 和H3O+。
和H3O+。
(4)甲烷电子式为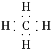 ,不存在孤电子对,且中心碳原子采用sp3杂化,故其立体构型为正四面体形。
,不存在孤电子对,且中心碳原子采用sp3杂化,故其立体构型为正四面体形。
(5)根据信息O![]() C知,C和O之间存在三个共价键,氮气中两个原子间也是三个共价键,与CO结构相似。但C和O电负性不同,共价键是极性键,而N2中两个氮原子形成的键是非极性键,O
C知,C和O之间存在三个共价键,氮气中两个原子间也是三个共价键,与CO结构相似。但C和O电负性不同,共价键是极性键,而N2中两个氮原子形成的键是非极性键,O![]() C中“→”表示氧原子单方提供电子对,是配位键。
C中“→”表示氧原子单方提供电子对,是配位键。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案