题目内容
【题目】“一带一路”将为中国化工企业开辟新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础.
(1)下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式 已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=﹣25kJmol﹣1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=﹣47kJmol﹣1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJmol﹣1③
(2)贵金属的冶炼中往往会产生有毒气体,先进技术使用NaBH4为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体. ①写出该反应的离子方程式: .
②在纳米钴的催化作用下,肼可以发生分解反应3N2H4(g) ![]() N2(g)+4NH3(g)
N2(g)+4NH3(g)
保持温度不变,向容积固定的容器中充入一定量的肼,下列描述能够说明体系处于平衡状态的是
a.容器内压强不随时间改变
b.单位时间内生成amol N2的同时,生成4molNH3
c.N2H4和NH3的物质的量之比保持不变的状态
d.混合气体的平均摩尔质量保持不变的状态
若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图1所示,其中曲线b表示的是(物质的化学式)的体积分数随温度的变化情况,为抑制肼的分解,可采取的合理措施有(任写一种).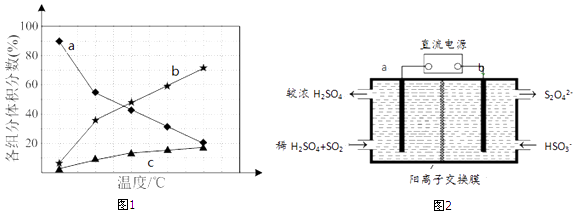
(3)大气污染气的主要成分是SO2和NO2 . 利用图2所示装置(电极均为惰性电极)可以吸收SO2 , 还可以用阴极排出的溶液吸收NO2 . ①a极为(填“阴”“阳”) b极的电极反应式为 .
②简述该装置能吸收SO2的原理: .
【答案】
(1)FeO(s)+CO(g)═Fe(s)+CO2(g)△H=﹣11KJ/mol
(2)2Co2++N2H4+4OH﹣=2Co↓+N2↑+4H2O;acd;NH3;降低反应温度或增加压强等
(3)阳;2HSO3﹣+2H++2e﹣═S2O42﹣+2H2O;SO2在a极发生氧化反应,电极反应式:SO2﹣2e﹣+2H2O=4H++SO42﹣ , H+通过阳离子交换膜进入b极室
【解析】解:(1)Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=﹣25KJ/mol…①, 3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=﹣47KJ/mol…②,
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19KJ/mol…③,
根据盖斯定律将方程式变形(3×①﹣②﹣2×③)÷6得:Fe(s)+CO(g)═Fe(s)+CO2(g),△H= ![]() =﹣11KJ/mol.
=﹣11KJ/mol.
所以答案是:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=﹣11KJ/mol;(2)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH﹣ , 生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,据此得出还有水生成,氧化还原反应中存在得失电子守恒以及元素守恒,故此反应的离子反应方程式为:2Co2++N2H4+4OH﹣=2Co↓+N2↑+4H2O,
所以答案是:2Co2++N2H4+4OH﹣=2Co↓+N2↑+4H2O;②化学平衡状态,反应的正逆反应速率相同,各成分含量保持不变分析选项,3N2H4(g) ![]() N2(g)+4NH3(g)反应是气体体积变化的反应;
N2(g)+4NH3(g)反应是气体体积变化的反应;
a.容器内压强不随时间改变,即各成分含量保持不变,能说明反应达到平衡状态,故a符合;
b.单位时间内生成amol N2的同时,生成4molNH3 , 都表示的是正反应,故不能说明正逆反应速率相同,不能说明反应达到平衡状态,故b不符合;
c.N2H4和NH3的物质的量之比保持不变,即各成分含量保持不变,故c符合;
d.混合气体的平均摩尔质量保持不变的前提是气体组成不变,故反应到达了平衡,故d符合;
故选acd;曲线b表示的是NH3的体积分数随温度的变化情况;为抑制肼的分解,可采取的合理措施有降低反应温度或增加压强等;
所以答案是:a c d;NH3;降低反应温度或增加压强等;(3)①依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极区发生反应SO2﹣2e﹣+2H2O═SO42﹣+4H+ , 与电源的正极相连的a为阳极,故a为阳极,b为阴极,阴极的电极反应式为:2HSO3﹣+2H++2e﹣═S2O42﹣+2H2O,
所以答案是:阳;2HSO3﹣+2H++2e﹣═S2O42﹣+2H2O;②该装置吸收SO2的原理是SO2在 a极发生氧化反应,电极反应式:SO2﹣2e﹣+2H2O=4H++SO42﹣ , H+通过阳离子交换膜进入b 极室,
所以答案是:SO2在 a极发生氧化反应,电极反应式:SO2﹣2e﹣+2H2O=4H++SO42﹣ , H+通过阳离子交换膜进入b 极室.
【考点精析】本题主要考查了化学平衡状态的判断的相关知识点,需要掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能正确解答此题.