题目内容
【题目】某有机物由C、H、O三种元素组成,将该有机物3g充分燃烧生成0.15mol二氧化碳和3.6g水,已知该有机物的蒸汽密度为2.68g/L(折算成标准状况),该有机物能与金属钠反应.试回答:
(1)通过计算求出该有机物的分子式.
(2)写出该有机物可能的结构简式.
【答案】
(1)解:有机物的蒸汽密度为2.68g/L,则其相对分子质量为2.68×22.4L=60g,该有机物3g充分燃烧生成0.15mol二氧化碳和3.6g水,3g有机物的物质的量= ![]() =0.05mol,3.6g H2O的物质的量为
=0.05mol,3.6g H2O的物质的量为 ![]() =0.2mol,根据原子守恒,可知有机物分子中N(C)=
=0.2mol,根据原子守恒,可知有机物分子中N(C)= ![]() =3、N(H)=
=3、N(H)= ![]() =8,则有机物分子中N(O)=
=8,则有机物分子中N(O)= ![]() =1,故有机物分子式为C3H8O,
=1,故有机物分子式为C3H8O,
答:该有机物分子式为C3H8O
(2)解:该有机物能与金属钠反应,有机物分子式为C3H8O,故有机物含有﹣OH,该有机物的结构简式为CH3CH2CH2OH、CH3CH(OH)CH3,
答:该有机物的结构简式为CH3CH2CH2OH、CH3CH(OH)CH3
【解析】有机物的蒸汽密度为2.68g/L,则其相对分子质量为2.68×22.4L=60g,根据原子守恒计算有机物分子中N(C)、N(H),再结合相对分子质量计算有机物分子中N(O),据此确定有机物分子式,该有机物能与金属钠反应,至少含有﹣COOH、﹣OH中的一种,结合有机物分子式书写可能的结构.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】在温度T1和T2时,分别将0.50mol CH4和1.20mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A.T2时CH4的平衡转化率为70.0%
B.该反应的△H>0、T1<T2
C.保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D.保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2 , 与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
【题目】下列说法正确的是( )
A | B | C | D |
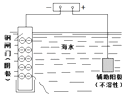
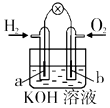
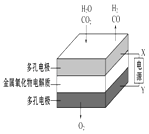
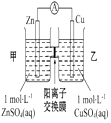
钢闸门容易被腐蚀 | a、b均为惰性电极,b极反应是:O+4OH﹣﹣4e﹣=2H2O | 阴、阳两极生成的气体的物质的量之比是1:1 | 电池工作一段时间 |
|
|
|
|
A.A
B.B
C.C
D.D