��Ŀ����
����Ŀ������������һ����ɫ����ζ�����Ҳ���ȼ�����壬�ڰ뵼��ӹ���̫���ܵ�������Һ����ʾ�������еõ��㷺Ӧ�ã�NF3��һ�������ͷ��ӣ�����102�����е���129��������ͭ�Ĵ���������F2����NH3��Ӧ�õ���
��1��д���Ʊ� NF3�Ļ�ѧ��Ӧ����ʽ�� ��
��2��NF3�ķе��NH3�ķе㣨��33�����͵ö����Ҫԭ���� ��
��3��NF3��NԪ�ز�ȡ ��ʽ�ӻ���
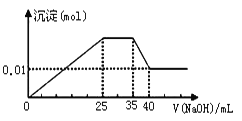
��4��������HF��NaAlO2��NaCl��6��1��2�����ʵ���֮��ǡ�÷�Ӧ����HCl��H2O��һ������ˮ����Ҫԭ�ϣ������ʺ�������Ԫ�أ�������ʵĻ�ѧʽΪ �����������ǣ���λ��Ϊ ��
��5����֪����Ԫ�أ���O����S����Se����Te������ҵ�Ͽ���Al2Te3���Ʊ�H2Te��������л�ѧ����ʽ��
Al2Te3+ �T Al��OH��3��+ H2Te��
��6����֪�ڳ����£�����17g H2S�ų�56.1KJ����������д������ֽ���Ȼ�ѧ����ʽ ��
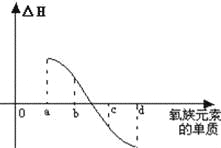
��7����ͼ��ʾΪ����Ԫ�ص�����H2��Ӧ�����е������仯ʾ��ͼ������a��b��c��d�ֱ��ʾ������ijһԪ�صĵ��ʣ���HΪ��ͬ���ʵ����ĵ�����H2��Ӧ�ķ�Ӧ�ȣ���b���� ��d���� ����д�������ƣ���
���𰸡���1��4NH3+3F2=NF3+3NH4F��
��2��NH3���γ������NF3ֻ�з��»�����
��3��sp3��
��4��Na3AlF6��Al3+��6��
��5��6H2O��2��3��
��6��H2S��g��=H2��g��+S��s����H="+112.2" kJmol��1��
��7������������
�������������������1��F2����NH3��Ӧ�õ�NF3��NH4F�����ԭ���غ������
��2��NH3�����������NF3ֻ���ڷ��Ӽ�����������������ô��ڷ��Ӽ���������
��3����������ԭ�ӵļ۲���Ӷ����жϣ�
��4��HF��NaAlO2��NaCl��6��1��2�����ʵ���֮��ǡ�÷�Ӧ����HCl��H2O��һ������ˮ����Ҫԭ�ϣ���Ӧ�Ļ�ѧ����ʽ��6HF+NaAl02+2NaCl�T2HCl+2H2O+Na3AlF6��Na3AlF6��������ΪAl3+����λ��Ϊ6��
��5����Al2Te3���Ʊ�H2Te����Ԫ���غ��֪����ˮ�μӣ�����Al��OH��3��H2Te��
��6���ڳ����£�����17g H2S�ų�56.1KJ����������1molH2S�ֽ�����112.2KJ������
��7����������Ԫ�صĵ������������ϵ�Խ��Խ�ѣ��Ƶ���a��b��c��d�ֱ�ΪTe��Se��S��O2��
�⣺��1�����ݷ�Ӧ����������Լ������غ㶨�ɿ�֪��Ӧ��Ӧ��NH4F���ɣ�
�ʴ�Ϊ��4NH3+3F2=NF3+3NH4F��
��2��NH3�����������NF3ֻ���ڷ��Ӽ�������������������ǰ�߽�ǿ�����ʵķе�ϸߣ�
�ʴ�Ϊ��NH3���γ������NF3ֻ�з��»�����
��3��NF3��Nԭ�ӵļ۲���Ӷ���=3+![]() ��5��3��1��=4���������ӻ�����Ϊsp3��
��5��3��1��=4���������ӻ�����Ϊsp3��
�ʴ�Ϊ��sp3��
��4���������֪�÷�Ӧ�Ļ�ѧ����ʽӦΪ��6HF+NaAl02+2NaCl�T2HCl+2H2O+Na3AlF6��������Ϊ��Na3AlF6����������ΪAl3+����λ��Ϊ6��
�ʴ�Ϊ��Na3AlF6��Al3+��6��
��5����ҵ�Ͽ���Al2Te3���Ʊ�H2Te����Ԫ���غ�������غ��֪���䷴Ӧ����ʽΪA12Te3+6H2O=2A1��OH��3��+3H2Te����
�ʴ�Ϊ��6H2O��2��3��
��6����H2��S��Ӧ����17g H2S�ų�56.1KJ������������ֽ���Ȼ�ѧ����ʽ��H2S��g��=H2��g��+S��s����H="+112.2" kJmol��1��
�ʴ�Ϊ��H2S��g��=H2��g��+S��s����H="+112.2" kJmol��1��
��7��������Ԫ�صĵ������������ϵ�Խ��Խ�ѣ��Ƶ���a��b��c��d�ֱ�ΪTe��Se��S��O2��
�ʴ�Ϊ������������

 ��У����ϵ�д�
��У����ϵ�д�