题目内容
【题目】(10分)
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
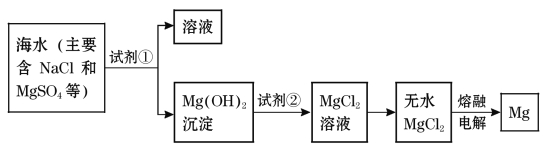
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用___________,要使MgSO4完全转化为沉淀,加入试剂①的量应_________________;
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_______________;
(3)试剂②可以选用___________________________;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方式 。
【答案】(1)NaOH溶液(其他合理答案均给分) 过量(或足量) (2)过滤
(3)稀盐酸 (4) MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
【解析】
试题分析:(1)MgSO4→Mg(OH)2需要向溶液中加入碱液,海水主要含氯化钠和硫酸镁,故加入NaOH溶液,为了让Mg2+全部转化成Mg(OH)2,氢氧化钠需过量;
(2)操作后出现溶液和沉淀,故分离的方法是过滤;
(3)Mg(OH)2→MgCl2,沉淀转化成溶液,需要加入盐酸才能实现;
(4)根据信息无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,反应方程式为MgCl2(熔融)![]() Mg+Cl2↑。
Mg+Cl2↑。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是________________;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是__________
A.CO32- + CH3COOH = CH3COO- + CO2 ↑ + H2O
B.ClO- + CH3COOH = CH3COO- + HClO
C.CO32- + HClO = CO2 ↑ + H2O + ClO-
D.2 ClO- + CO2 + H2O = CO32-+ 2 HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是__________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/ KW D.c(H+)/c(OH-)
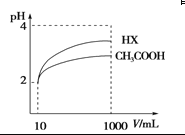
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化 如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)