��Ŀ����
����Ŀ��ij��ɫ��Һ��ֻ���ܺ������������е������֣�����ˮ���������H����OH������H+��NH4����K����Mg2����Fe3+��Al3����NO3һ��CO32һ��SO42������ȡ����100 mL��Һ��������ʵ�飺
�� ��һ�ݼ�����AgNO3��Һ���а�ɫ����������
�� �ڶ��ݼ�����BaCl2��Һ���а�ɫ������������ϴ�ӡ������������Ϊ4.66 g��
�� ��������εμ�NaOH��Һ����ó�����NaOH��Һ�������ϵ����ͼ��
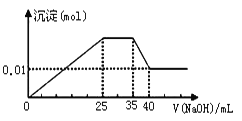
��������ʵ�飬�����Ʋ�����ȷ������ ��
A�����ݵ���غ㣬ԭ��Һ��NO3�������ʵ���ӦΪ0.03 mol
B��ԭ��Һһ��������H����Fe3����CO32��
C��ԭ��Һȷ����Mg2����Al3����NH4������n(Mg2��)��n(Al3��)��n( NH4��) = 1��1��2
D��ʵ�����ӵ�NaOH��Ũ��Ϊ2 mol��L��1
���𰸡�A
��������
���������D����ʵ������ͼ���֪������Һ�в���H+������Al3����Mg2����NH4����������NaOH�Ⱥ����ķ�Ӧ˳��Ϊ��Al3�� + 3 OH�� = Al(OH)3����Mg2�� + 2 OH�� = Mg(OH)2����NH4�� + OH�� = NH3�� + H2O��Al(OH)3 + OH�� = AlO2�� + 2 H2O����ȫ����Al3��������OH����NaOH�����ʵ�������ȫ�ܽ�Al(OH)3������3����ͼ����ȫ�ܽ�Al(OH)3����������NaOH��Һ�����Ϊ��40-35��mL=5mL������ȫ����Al3��������NaOH��Һ�����Ϊ5 mL��3=15 mL������ȫ��ȫ����Mg2��ʱ������NaOH��Һ�����Ϊ��25-15�� mL=10 mL����ͼ��֪��Mg(OH)2Ϊ0.01 mol�����ԭ��Һ��0.01 mol Mg2��������ȫ����ʱ��Ҫ����0.02 mol OH����NaOH����n/V=c��֪����NaOH��Ũ��Ϊ0.02 mol ��10 �� 10��3L = 2 mol��L��1��D����C����cV=n��֪����ȫ����Al3��������OH����NaOHΪ2 mol��L��1��15 �� 10��3L = 0.03 mol����Al3�� + 3 OH�� = Al(OH)3����֪��ԭ��Һ��Al3��Ϊ0.01mol����ȫ����NH4������OH����NaOHΪ2 mol��L��1��(35-25)�� 10��3L = 0.02 mol����NH4�� + OH�� = NH3�� + H2O��֪��ԭ��ҺNH4��Ϊ0.02 mol����n(Mg2��)��n(Al3��)��n( NH4��)=0.01 ��0.01 ��0.02 = 1��1��2��C��ȷ��B����ɫ��Һ�����ڻ�ɫ��Fe3��������Mg2����Al3������������CO32���������ܷ���˫ˮ�ⷴӦ��B��ȷ��A����ʵ������֪��ԭ��Һ����SO42������SO42�� + Ba2+ = BaSO4����m/M=n��֪��BaSO4Ϊ4.66 g �� 233 g/mol=0.02 mol����ԭ��Һ��0.02 mol SO42����n(�����) = 3 n(Al3��) + 2 n(Mg2��) + n(NH4��) = 0.01mol��3 + 0.01mol��2 + 0.02mol��1=0.07 mol��n(�����) = 2n(SO42��) = 0.02 mol��2 = 0.04 mol�����ݵ���غ��֪ԭ��Һ�к�NO3���������ڿ��ܻ�����K+�����NO3������Ӧ��0.03mol��A��������ѡA��

 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�