题目内容
【题目】A、B、C、D、E是短周期的五种主族元素.A元素的某种原子,其核内没有中子;B元素的基态原子2p轨道上只有一对成对电子;C与B处于同一周期,且原子半径小于B;D与C是同主族元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构.根据上述信息回答下列问题:
(1)B元素的原子结构示意图是 ;C元素原子的轨道表示式是 ;D元素原子的价电子排布式是 ;
(2)A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是(用化学式表示) ;
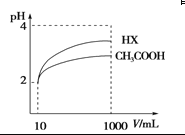
(3)由B、D、E三种元素组成的某种化合物的水溶液能使pH试纸先变蓝后褪色,写出该化合物的化学式 ;用一个离子方程式表明该化合物水溶液使pH试纸先变蓝后褪色的原因 .
【答案】(1)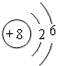 ;
;![]() ;3s23p5;
;3s23p5;
(2)HF>HCl;
(3)NaClO;ClO﹣+H2OHClO+OH﹣
【解析】试题分析:A、B、C、D、E是短周期的五种主族元素,A元素的某种原子,其核内没有中子,则A为氢元素;B元素的基态原子2p轨道上只有一对成对电子,则B为氧元素;C与B处于同一周期,且原子半径小于B,则C为氟元素;D与C是同主族元素,则D为氯元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构,则E为钠元素,据此答题.
解:A、B、C、D、E是短周期的五种主族元素,A元素的某种原子,其核内没有中子,则A为氢元素;B元素的基态原子2p轨道上只有一对成对电子,则B为氧元素;C与B处于同一周期,且原子半径小于B,则C为氟元素;D与C是同主族元素,则D为氯元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构,则E为钠元素,
(1)B为氧元素,它的原子结构示意图是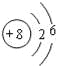 ;C为氟元素,它的原子的轨道表示式是
;C为氟元素,它的原子的轨道表示式是![]() ;D为氯元素,它的原子的价电子排布式是3s23p5,
;D为氯元素,它的原子的价电子排布式是3s23p5,
故答案为: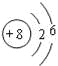 ;
;![]() ;3s23p5;
;3s23p5;
(2)A元素分别与C、D两元素形成的化合物为HF和HCl,由于F的非金属性强于Cl,所以HF的稳定性强于HCl,
故答案为:HF>HCl;
(3)由B、D、E三种元素组成的某种化合物的水溶液能使pH试纸先变蓝后褪色,说明该物质溶液显碱性,还有漂白性,所以该化合物的化学式为NaClO,NaClO水解溶液呈碱性,生成的次氯酸能漂白,反应的离子方程式为ClO﹣+H2OHClO+OH﹣,
故答案为;NaClO;ClO﹣+H2OHClO+OH﹣;

【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是________________;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是__________
A.CO32- + CH3COOH = CH3COO- + CO2 ↑ + H2O
B.ClO- + CH3COOH = CH3COO- + HClO
C.CO32- + HClO = CO2 ↑ + H2O + ClO-
D.2 ClO- + CO2 + H2O = CO32-+ 2 HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是__________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/ KW D.c(H+)/c(OH-)
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化 如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)