题目内容
13.下列物质中,只存在离子键的是②⑨,只存在共价键的是①④⑤⑦,既存在离子键又存在共价键的是③⑧⑩,不存在化学键的是⑥,属于离子化合物的是②③⑧⑨⑩,属于共价化合物的是④⑤⑦.①N2②MgCl2③NH4Cl ④CH4⑤CO2⑥Ne ⑦H2S ⑧KOH ⑨Na2O ⑩Na2O2.
分析 ①N2只存在共价键;
②MgCl2只存在离子键,属于离子化合物;
③NH4Cl含离子键、极性共价键,属于离子化合物;
④CH4只存在共价键,属于共价化合物;
⑤CO2只存在共价键,属于共价化合物;
⑥Ne不存在化学键;
⑦H2S只存在共价键,属于共价化合物;
⑧KOH含离子键、极性共价键,属于离子化合物;
⑨Na2O含离子键,属于离子化合物;
⑩Na2O2含离子键、非极性共价键,属于离子化合物,由此分析解答.
解答 解:①N2只存在共价键;
②MgCl2只存在离子键,属于离子化合物;
③NH4Cl含离子键、极性共价键,属于离子化合物;
④CH4只存在共价键,属于共价化合物;
⑤CO2只存在共价键,属于共价化合物;
⑥Ne不存在化学键;
⑦H2S只存在共价键,属于共价化合物;
⑧KOH含离子键、极性共价键,属于离子化合物;
⑨Na2O含离子键,属于离子化合物;
⑩Na2O2含离子键、非极性共价键,属于离子化合物;
故答案为:②⑨;①④⑤⑦;③⑧⑩;⑥; ②③⑧⑨⑩;④⑤⑦
点评 本题考查了离子键、共价键、离子化合物、共价化合物的定义,侧重考查学生对这些概念的辨别能力;要注意的是:稀有气体是单原子分子,不存在化学键,只存在分子间作用力.

练习册系列答案
相关题目
1.某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.
每次实验HNO3的用量为25.0mL、大理石用量为10.00g.提供的试剂还有:HNO3(1.00mol•L-1、2.00mol•L-1)块状大理石、粉末状大理石
请依据实验目的帮助该探究小组完成实验设计表格,并回答相关问题:
实验①和②探究HNO3浓度对该反应速率的影响;
实验①和③探究温度对该反应速率的影响;
实验①和④探究大理石规格(粗、细)对该反应速率的影响;
每次实验HNO3的用量为25.0mL、大理石用量为10.00g.提供的试剂还有:HNO3(1.00mol•L-1、2.00mol•L-1)块状大理石、粉末状大理石
请依据实验目的帮助该探究小组完成实验设计表格,并回答相关问题:
实验①和②探究HNO3浓度对该反应速率的影响;
实验①和③探究温度对该反应速率的影响;
实验①和④探究大理石规格(粗、细)对该反应速率的影响;
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 298 | 块状 | 2.00 |
| ② | |||
| ③ | 308 | 块状 | 2.00 |
| ④ |
8.某温度时,测得纯水中c(H+)=2×10-7 mol/L,则此时c(OH-)为( )
| A. | 0.5×10-7 mol/L | B. | 1×10-7 mol/L | C. | 2×10-7 mol/L | D. | 4×10-7 mol/L |
18.100℃时,KW=1×10-12,对纯水的叙述正确的是( )
| A. | KW是常温时的10-2倍 | B. | 温度不变冲稀10倍,pH=7 | ||
| C. | pH=6显弱酸性 | D. | c(H+)=10-6mol/L,溶液为中性 |
 在一定温度下,4L密闭容器内存在反应2N?M,其中气体M、气体N的物质的量随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内存在反应2N?M,其中气体M、气体N的物质的量随时间变化的曲线如图所示: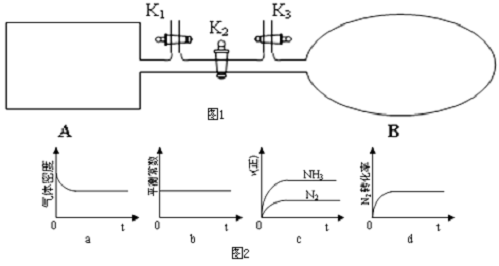

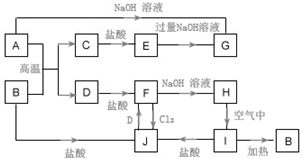 A~J为中学化学的常见物质,它们之间有如图所示的转化关系(部分产物已略去).已知A、D为金属单质,B为红棕色粉末,I为红褐色固体.
A~J为中学化学的常见物质,它们之间有如图所示的转化关系(部分产物已略去).已知A、D为金属单质,B为红棕色粉末,I为红褐色固体.