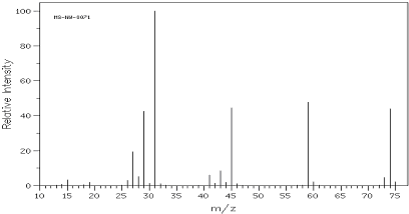
题目内容
3.室温下,下列溶液中粒子浓度关系正确的是( )| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c (H2S) | |
| B. | Na2C2O4溶液:c (OH-)=c(H+)+c(HC2O4-)+2c (H2C2O4) | |
| C. | Na2CO3溶液:c (Na+)+c (H+)=2c (CO32-)+c (OH-) | |
| D. | CH3COONa和CaCl2混合溶液:c (Na+)+c (Ca2+)=c (CH3COO-)+c (CH3COOH)+2c (Cl-) |
分析 A.Na2S溶液中存在两步水解,c(OH-)>c(HS-);
B.根据Na2C2O4溶液中的质子守恒分析;
C.溶液中存在电荷守恒;
D.由物料守恒分析.
解答 解:A.Na2S溶液中存在两步水解,两步水解均生成OH-,则c(OH-)>c(HS-),由于水解程度较小,则浓度最大的是钠离子,所以c(Na+)>c(OH-)>c(HS-)>c (H2S),故A错误;
B.在Na2C2O4溶液中存在质子守恒,即水电离的氢离子等于水电离的氢氧根离子,则c (OH-)=c(H+)+c(HC2O4-)+2c (H2C2O4),故B正确;
C.溶液中存在电荷守恒,即阳离子所带的正电荷总浓度等于阴离子所带的负电荷总浓度,所以c (Na+)+c(H+)=2c (CO32-)+c (HCO3-)+c(OH-)故C错误;
D.CH3COONa和CaCl2混合溶液中存在物料守恒,即:c(Na+)=c(CH3COO-)+c(CH3COOH),2c(Ca2+)=c (Cl-),所以c (Na+)+2c (Ca2+)=c (CH3COO-)+c(CH3COOH)+c (Cl-),故D错误.
故选B.
点评 本题考查了盐类水解的应用,离子浓度大小比较方法,注意溶液中电荷守恒的计算应用和物料守恒的分析判断,题目难度中等.

练习册系列答案
相关题目
13.下列反应的离子方程式正确的是( )
| A. | 用氨水吸收少量的二氧化硫:NH3•H2O+SO2═NH4++HSO3- | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 次氯酸钙溶液中通入过量的二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | |
| D. | 碳酸钠溶液中慢慢滴入少量稀盐酸:CO32-+2H+═CO2↑+H2O |
14.下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
| A. | CH2=CH2+Br2(CCl4)→ | B. | CH2=CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | ||
| C. | C(CH3)4+Cl2$\stackrel{光照}{→}$ | D. | n CH3-CH=CH2$→_{△}^{催化剂}$ |
18.2gAO32-的核外电子数比质子数多3.01×1022个,则A的相对原子质量为( )
| A. | 12 | B. | 32 | C. | 60 | D. | 80 |
15.下列反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| B. | 向漂白粉溶液中加入过量浓盐酸:ClO-+H+=HClO | |
| C. | “万能还原剂”NaBH4与水反应得到NaBO2:BH4-+2H2O=BO2-+4H2↑ | |
| D. | 向FeSO4溶液中加入Na2O2:2Na2O2+2Fe2++2H2O=4Na++2Fe(OH)2↓+O2↑ |

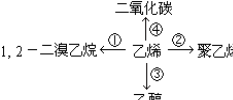
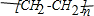 ③CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH④CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O.
③CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH④CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O.
 2C(g)+B(g)△H=+150akJ/mol.
2C(g)+B(g)△H=+150akJ/mol.