题目内容
18.下列物质所含粒子数为0.1NA(NA为阿伏加德罗常数的值)的是( )| A. | 0.1 mo1 Na2O2所含的阴离子 | |
| B. | 1 L0.1 mol•L-1氨水中的NH${\;}_{4}^{+}$ | |
| C. | 12.5mL 16 mo1•L-1的浓硫酸能溶解的Cu | |
| D. | 4.6g N02气体所含的分子 |
分析 A、Na2O2由钠离子和O22-构成;
B、NH3•H2O是弱电解质,在溶液中不能完全电离;
C、铜只能与浓硫酸反应;
D、N02气体中存在平衡:2N02?N204;
解答 解:A、Na2O2由2mol钠离子和1molO22-构成,即1molNa2O2中含1mol阴离子,故0.1molNa2O2中含0.1mol阴离子,故A正确;
B、NH3•H2O是弱电解质,在溶液中不能完全电离,故1 L0.1 mol•L-1氨水中的NH4+小于0.1mol,故B错误;
C、铜只能与浓硫酸反应,一旦硫酸变稀则反应即停止,则浓硫酸不能完全反应,故反应掉的铜的物质的量小于0.1mol,故C错误;
D、4.6gN02的物质的量为0.1mol,而N02气体中存在平衡:2N02?N204,导致气体的分子数小于0.1NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,难度不大.

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
9.下列说法错误的是( )
| A. | 按系统命名法,化合物  的名称为2,3-二甲基丁烷 的名称为2,3-二甲基丁烷 | |
| B. | 等质量的甲醛、乙酸、葡萄糖完全燃烧耗氧量相等 | |
| C. | 在一定条件下,使煤和氢气作用,可以得到液体燃料 | |
| D. | 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色 |
6.现有甲、乙、丙、丁四种短周期元素,它们之间的关系如下:
Ⅰ.乙元素的主要化合价:最高正价+最低负价=2
Ⅱ.原子的核外电子层数:丁>乙=丙=2甲
III.原子的最外层电子数:甲+丙=乙+丁=8
则下列说法不正确的是( )
Ⅰ.乙元素的主要化合价:最高正价+最低负价=2
Ⅱ.原子的核外电子层数:丁>乙=丙=2甲
III.原子的最外层电子数:甲+丙=乙+丁=8
则下列说法不正确的是( )
| A. | 乙原子的最外层有5个电子,其氢化物含有极性键 | |
| B. | 四种元素中丙的非金属性最强,其最高价氧化物对应的含氧酸酸性最强 | |
| C. | 丁元素的氧化物对应的水化物与乙元素最高价氧化物对应水化物完全反应形成的盐的溶液显酸性 | |
| D. | 乙、丙两元素形成的氢化物稳定性丙的强于乙 |
13.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.6g甲烷含有的电子数为NA | |
| B. | 1 L0.1 mol/L NaHCO3溶液中含有的HCO3- 数目为0.1 NA | |
| C. | 1 L PH=1的硫酸溶液中含有的H+ 数为0.2 NA | |
| D. | 标准状况下,2.24 LCO和CO2混合气体中含有的氧原子数为0.15NA |
10.下列装置所示的实验中,能够达到实验目的是( )
| A. |  用铜和稀硝酸制取NO | B. |  分离乙醇和乙酸 | ||
| C. | 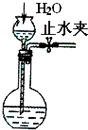 检查装置气密性 | D. | 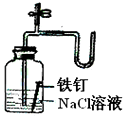 证明铁生锈空气参与反应 |
7.下列与金属腐蚀有关的说法正确的是( )
| A. | 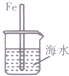 图中,插人海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 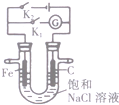 图中,闭合K2,铁电极的腐蚀速率比闭合K1时慢 | |
| C. | 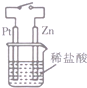 图中,接通开关时,Zn的腐蚀速率增大,Zn上放出气体的速率也增大 | |
| D. | 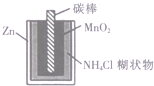 图中,锌锰电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
6.下列有机物中,可能使酸性高锰酸钾溶液褪色的是( )
| A. | CH4 | B. | C2H4O2 | C. | 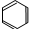 | D. | C8H18 |
 铜及其化合物在现代生活中应用广泛.
铜及其化合物在现代生活中应用广泛.