题目内容
19.关于下列各装置图的叙述中,不正确的是( )| A. | 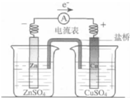 图中总反应为Zn+CuSO4═Cu+ZnSO4 | |
| B. | 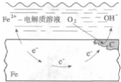 图中正极反应为2H2O+O 2+4e-═4OH- | |
| C. | 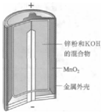 图中负极反应为Zn+2OH--2e-═Zn(OH)2 | |
| D. |  图中向Fe电极区滴入2滴铁氰化钾溶液产生蓝色沉淀 |
分析 A.可形成铜锌原电池,总反应即为自发的氧化还原反应;
B.该装置为铁的吸氧腐蚀,正极发生得电子的还原反应;
C.该装置为锌锰碱性电池,负极发生失电子的氧化反应;
D.可形成铁锌原电池,铁为正极,锌为负极.
解答 解:A.锌为负极、铜为正极,可形成铜锌原电池,总反应即为自发的氧化还原反应,即Zn+CuSO4═Cu+ZnSO4,故A正确;
B.该装置为铁的吸氧腐蚀,正极反应为2H2O+O 2+4e-═4OH-,故B正确;
C.该装置为锌锰碱性电池,负极发生失电子的氧化反应,反应式为Zn+2OH--2e-═Zn(OH)2,故C正确;
D.可形成铁锌原电池,铁为正极,锌为负极,Fe电极区为氢离子得电子生成氢气,所以滴入2滴铁氰化钾溶液不会产生蓝色沉淀,故D错误.
故选D.
点评 本题考查原电池原理等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握电极反应失解题的根据,难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
7.工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+O2?2SO3,这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下述有关说法不正确的是( )
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 在上述条件下,SO2不可能100%地转化为SO3 | |
| C. | 化工生产中,可通过改变温度、浓度、压强等因素,提高SO2的转化率 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度相等 |
10.下列有关物质的性质、应用或制取的说法正确的是( )
| A. | 自来水厂可用明矾对水进行消毒杀菌 | |
| B. | 工业上将氯气通入澄清石灰水中,制取漂白粉 | |
| C. | 除去氯化钙溶液中少量盐酸,加入足量碳酸钙粉末,充分搅拌再过滤 | |
| D. | 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 |
7.下列说法正确的是( )
| A. | 1mL pH=2的醋酸溶液加水稀释到10mL,pH变为3 | |
| B. | 常温下,Na2CO3溶液中加水稀释时,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| C. | 向氯水中加入少量NaOH溶液,一定有c(Na+)=c(Cl-)+c(ClO-) | |
| D. | NH4Cl溶液稀释过程中.c(NH4+)与c(NH3•H2O)之和始终保持不变 |
14.实验室常用反应NaNO2+NH4Cl=NaCl+N2↑+2H2O制取N2.下列有关说法正确的是( )
| A. | NaNO2是氧化剂 | B. | N2的电子式是 | ||
| C. | 生成1 mol N2时转移6 mol 电子 | D. | 氧化剂和还原剂的质量之比是1:1 |
4.图为Pt电极的氢氧燃料电池工作原理示意图,H2SO4为电解质溶液.有关说法不正确的是( )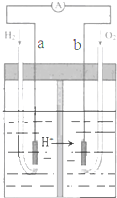

| A. | a极为负极,电子由a极流向b极 | |
| B. | a极的电极反应式是:H2-2e-=2H+ | |
| C. | 电池工作一段时间后,装置中c(H2SO4)增大 | |
| D. | 若将H2改为等物质的量CH4,O2的用量增多 |
11.下列反应前后物质的总能量变化可用如图表示的是( )


| A. | H-F═H+F | B. | Mg+2H+=Mg2++H2↑ | ||
| C. | 2Na+2H2O=2Na++2OH-+H2↑ | D. | HNO3+NaOH=NaNO3+H2O |
9.下列说法错误的是( )
| A. | 按系统命名法,化合物 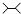 的名称为2,3-二甲基丁烷 的名称为2,3-二甲基丁烷 | |
| B. | 等质量的甲醛、乙酸、葡萄糖完全燃烧耗氧量相等 | |
| C. | 在一定条件下,使煤和氢气作用,可以得到液体燃料 | |
| D. | 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色 |