题目内容
16.如图,下列装置属于原电池的是( )| A. | 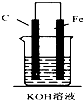 | B. | 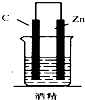 | C. | 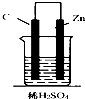 | D. |  |
分析 原电池的构成条件:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发进行的氧化还原反应,据此分析.
解答 解:A、不能自发进行的氧化还原反应,不是原电池,故A错误;
B、没有电解质溶液,不能形成原电池,故B错误;
C、符合原电池的构成条件,所以能构成原电池,故C正确;
D、没有两个活泼性不同的电极,所以不能构成原电池,故D错误;
故选C.
点评 本题考查了原电池的构成条件、原电池原理,明确原电池的构成条件、原电池原理内涵是解本题关键,题目难度不大.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 1mL pH=2的醋酸溶液加水稀释到10mL,pH变为3 | |
| B. | 常温下,Na2CO3溶液中加水稀释时,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| C. | 向氯水中加入少量NaOH溶液,一定有c(Na+)=c(Cl-)+c(ClO-) | |
| D. | NH4Cl溶液稀释过程中.c(NH4+)与c(NH3•H2O)之和始终保持不变 |
4.图为Pt电极的氢氧燃料电池工作原理示意图,H2SO4为电解质溶液.有关说法不正确的是( )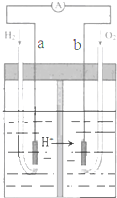

| A. | a极为负极,电子由a极流向b极 | |
| B. | a极的电极反应式是:H2-2e-=2H+ | |
| C. | 电池工作一段时间后,装置中c(H2SO4)增大 | |
| D. | 若将H2改为等物质的量CH4,O2的用量增多 |
11.下列反应前后物质的总能量变化可用如图表示的是( )


| A. | H-F═H+F | B. | Mg+2H+=Mg2++H2↑ | ||
| C. | 2Na+2H2O=2Na++2OH-+H2↑ | D. | HNO3+NaOH=NaNO3+H2O |
1.下列有关氯化钠的实验中,选用的实验用品都能用到的是( )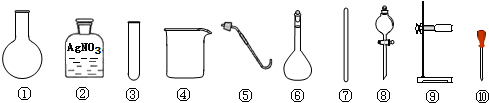

| A. | 除去粗盐中的不溶性杂质,选用 ④⑦⑧⑨ | |
| B. | 检验A的滤液中是否含SO42-,选用 ②③⑩ | |
| C. | 利用提纯后的NaCl固体配制0.1mol/L的溶液,选用 ④⑥⑦⑩ | |
| D. | 用NaCl固体与浓H2SO4共热制备HCl气体,选用 ①⑤⑧⑨ |
5.下列物质与常用危险化学品的类别不对应的是( )
| A. | 氢氧化钠--腐蚀品 | B. | 高锰酸钾--氧化剂 | ||
| C. | 钠--遇湿易燃物品 | D. | 甲烷--易燃液体 |
6.现有甲、乙、丙、丁四种短周期元素,它们之间的关系如下:
Ⅰ.乙元素的主要化合价:最高正价+最低负价=2
Ⅱ.原子的核外电子层数:丁>乙=丙=2甲
III.原子的最外层电子数:甲+丙=乙+丁=8
则下列说法不正确的是( )
Ⅰ.乙元素的主要化合价:最高正价+最低负价=2
Ⅱ.原子的核外电子层数:丁>乙=丙=2甲
III.原子的最外层电子数:甲+丙=乙+丁=8
则下列说法不正确的是( )
| A. | 乙原子的最外层有5个电子,其氢化物含有极性键 | |
| B. | 四种元素中丙的非金属性最强,其最高价氧化物对应的含氧酸酸性最强 | |
| C. | 丁元素的氧化物对应的水化物与乙元素最高价氧化物对应水化物完全反应形成的盐的溶液显酸性 | |
| D. | 乙、丙两元素形成的氢化物稳定性丙的强于乙 |