题目内容
13.检验某未知溶液中是否含有SO${\;}_{4}^{2-}$的下列操作中最合理的是( )| A. | 加入硝酸酸化的Ba(NO3)2 | B. | 先加HNO3酸化,再加Ba(NO3)2溶液 | ||
| C. | 先加盐酸酸化,再加BaCl2溶液 | D. | 加入盐酸酸化了的BaCl2溶液 |
分析 检验某未知溶液中是否含有SO42-,应先加盐酸排除其它离子的干扰如碳酸根离子、亚硫酸根离子、银离子等的干扰,再加氯化钡,以此来解答.
解答 解:A.加入HNO3酸化了的Ba(NO3)2溶液,若为亚硫酸根离子也生成白色沉淀,不能检验,故A错误;
B.先加入HNO3酸化,若为亚硫酸根离子,亚硫酸根离子被硝酸氧化成硫酸根离子,再加Ba(NO3)2,生成白色沉淀硫酸钡,不能检验,故B错误;
C.先加入盐酸酸化,以除去 SO32-、CO32- 等离子的影响,同时,当加入稀盐酸时没有沉淀,可排除Cl-的影响,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-,故C正确;
D.先入HCl酸化了的BaCl2溶液,生成白色沉淀可能为AgCl,不能检验,故D错误;
故选C.
点评 本题考查物质的检验和鉴别,侧重于学生的分析能力和实验能力的考查,为高频考点,注意检验离子的试剂及试剂的加入顺序,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.科学家刚刚发现了某种元素的原子,其质量是ag,12C的原子质量是bg,NA是阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 该原子的摩尔质量是aNAg/mol | |
| B. | Wg该原子的物质的量一定是$\frac{W}{{a{N_A}}}$mol | |
| C. | Wg该原子中含有$\frac{w}{a}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{b}{12}$ |
9.以下物质在水溶液中的电离方程式错误的是( )
| A. | MgSO4═Mg2++SO42- | B. | Fe(OH)3═Fe3++3OH- | ||
| C. | NaHCO3═Na++HCO3- | D. | KAl(SO4)2═K++Al3++2SO42- |
18.下列各组中的元素,属于同一周期的是( )
| A. | Mg、Al、P | B. | O、Na、S | C. | N、O、Cl | D. | H、Li、Na |
5.下列叙述不正确的是( )
| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗,发生的反应为2Na+O2═Na2O2 | |
| B. | 4.6gNa与O2完全反应,生成7g产物时失去电子的物质的量为0.2 mol | |
| C. | Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑ | |
| D. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 |
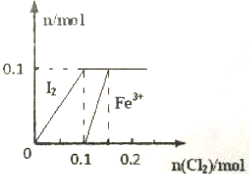 某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应: