题目内容
2.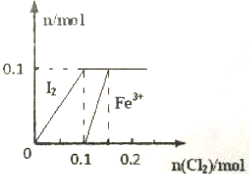 某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:①Cl2+2I-═2Cl-+I2
②Cl2+2Fe2+═2Cl-+2Fe3+
③5Cl2+I2+6H2O═10Cl-+2IO3-+12H+
其中Fe3+,I2的物质的量随n(Cl2)的变化如图所示.
请回答下列问题:
(1)当n(Cl2)=0.13mol时,不考虑水的电离及金属离子的水解,分析溶液中所含金属阳离子,以及其物质的量0.04molFe2+,0.06molFe3+(写出必要的计算过程,否则不得分).
(2)当溶液中n(Cl-):n(IO3-)=10:1时,通入的Cl2在标准状况下的体积为6.72L(写出必要的计算过程,否则不得分)
分析 (1)根据图象,结合反应Cl2+FeI2=FeCl2+I2 知,当通入0.1molCl2时碘离子完全被氧化生成碘单质,碘化亚铁的物质的量是0.1mol,结合方程式计算生成的;
(2)当溶液中n(Cl-):n(IO3-)=10:1时,Fe2+全部被氧化为Fe3+,由(1)可知碘化亚铁的物质的量是0.1mol,设碘酸根的物质的量是x,则氯离子的物质的量是10x,根据氧化还原反应中得失电子数相等计算x,再根据原子守恒计算出消耗的氯气.
解答 解:(1)根据图象,结合反应Cl2+FeI2=FeCl2+I2 知,当通入0.1molCl2时碘离子完全被氧化生成碘单质,碘化亚铁的物质的量是0.1mol,
剩余的0.03molCl2与Fe2+反应生成Fe3+,由Cl2+2Fe2+═2Cl-+2Fe3+可知0.03molCl2消耗0.06molFe2+,生成0.06molFe3+,则溶液中剩余0.04molFe2+,
故答案为:0.04molFe2+,0.06molFe3+;
(2)当溶液中n(Cl-):n(IO3-)=10:1时,碘离子转化为碘酸根离子时,Fe2+全部被氧化为Fe3+,由(1)可知碘化亚铁的物质的量是0.1mol,
设碘酸根的物质的量是x,则氯离子的物质的量是10x,根据氧化还原反应中得失电子数相等得x×6+(0.2-x)×1+0.1×1=10x×1,x=0.06,所以溶液中碘酸根的物质的量是0.06mol,氯离子的物质的量是0.6mol,根据Cl2~2Cl-知,氯气的物质的量是0.3mol,氯气的体积=0.3mol×22.4L/mol=6.72L,
故答案为:6.72.
点评 本题考查了氧化还原反应、有关化学方程式的计算,题目难度中等,侧重于考查学生的计算能力和分析能力,注意原子守恒和电子守恒在计算中的应用.

 字词句段篇系列答案
字词句段篇系列答案①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量
⑤反应前后溶液温度变化 ⑥操作所需的时间.
| A. | ①②③⑤ | B. | ①③④⑥ | C. | ③④⑤⑥ | D. | 全部 |
| A. | 加入硝酸酸化的Ba(NO3)2 | B. | 先加HNO3酸化,再加Ba(NO3)2溶液 | ||
| C. | 先加盐酸酸化,再加BaCl2溶液 | D. | 加入盐酸酸化了的BaCl2溶液 |
| A. | CaO中混有CaCO3(高温煅烧) | B. | CO混有CO2(石灰水) | ||
| C. | H2中混有HCl(NaOH溶液) | D. | Ca(OH)2中混有CaCO3(盐酸) |
| A. | 电石投入食盐水 | B. | 铜投入浓硝酸 | ||
| C. | 炭投入热的浓硫酸 | D. | 碳酸钙投入盐酸 |
 吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下: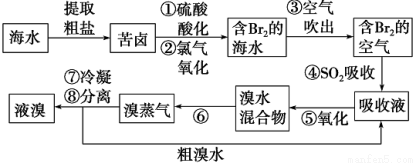
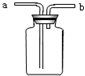 集气瓶被誉为“万能瓶”,如下图装置是其中的一种.当被收集的气体从a口进入时,瓶内空气从b口排出,相当于向上排空气法收集气体.现若将被收集的气体从b口进入,则它可收集的气体为:①H2 ②O2 ③CO2( )
集气瓶被誉为“万能瓶”,如下图装置是其中的一种.当被收集的气体从a口进入时,瓶内空气从b口排出,相当于向上排空气法收集气体.现若将被收集的气体从b口进入,则它可收集的气体为:①H2 ②O2 ③CO2( )