题目内容
5.下列叙述不正确的是( )| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗,发生的反应为2Na+O2═Na2O2 | |
| B. | 4.6gNa与O2完全反应,生成7g产物时失去电子的物质的量为0.2 mol | |
| C. | Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑ | |
| D. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 |
分析 A、钠在通常条件下反应生成氧化钠;
B、依据质量换算物质的量,结合钠与氧气反应时钠与电子的关系来解答;
C、Na与稀硫酸反应生成硫酸钠和氢气;
D、钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀.
解答 解:A、钠在通常条件下反应生成氧化钠,点燃条件生成过氧化钠,故A错误;
B、4.6gNa的物质的为0.2mol,钠与氧气反应时1个钠转移1个电子,所以失去电子的物质的量为0.2 mol,故B正确;
C、Na与稀硫酸反应生成硫酸钠和氢气,离子方程式为:2Na+2H+═2Na++H2↑,故C正确;
D、钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,将少量Na投入到CuS04溶液中,既有沉淀生成又有气体放出,故D正确;
故选A.
点评 本题考查物质性质的分析应用,反应条件和原理的判断,金属钠性质的分析应用是解题关键,题目较简单.

练习册系列答案
相关题目
16.下列说法不正确的是( )
| A. | 金属单质和盐溶液的反应不一定是置换反应 | |
| B. | “水滴石穿”是因为CaCO3与CO2、水发生了化学反应 | |
| C. | 纯碱是制作面包等糕点的膨松剂,也是治疗胃酸过多的一种药剂 | |
| D. | 少量液溴可用水封存,防止溴挥发 |
17.下列叙述中,可以表明N2+3H2═2NH3的反应达到平衡状态的是( )
| A. | 1mol N≡N键断裂的同时,有3mOLH-H键形成 | |
| B. | 1molN≡N键断裂的同时,有3molH-H键断裂 | |
| C. | 1molN≡N键断裂的同时,有6molN-H键形成 | |
| D. | 1molN≡N键断裂的同时,有6molN-H键断裂 |
13.检验某未知溶液中是否含有SO${\;}_{4}^{2-}$的下列操作中最合理的是( )
| A. | 加入硝酸酸化的Ba(NO3)2 | B. | 先加HNO3酸化,再加Ba(NO3)2溶液 | ||
| C. | 先加盐酸酸化,再加BaCl2溶液 | D. | 加入盐酸酸化了的BaCl2溶液 |
20.向氯化亚铁溶液中滴入氢氧化钠溶液后,沉淀颜色变化顺序为( )
| A. | 红褐色、灰绿色、白色 | B. | 白色、红褐色、黑色 | ||
| C. | 白色、灰绿色、红褐色 | D. | 蓝色、灰绿色、绿色 |
10.下列各项括号里的物质或操作是除去杂质所用的药品或方法,其中错误的是( )
| A. | CaO中混有CaCO3(高温煅烧) | B. | CO混有CO2(石灰水) | ||
| C. | H2中混有HCl(NaOH溶液) | D. | Ca(OH)2中混有CaCO3(盐酸) |
13.今年6月11日开始的全国节能宣传周的主题是“节约能源,从我做起.”在生活中以下行为不被提倡的是( )
| A. | 夏季用空调时,把设定温度适当调高 | |
| B. | 让电视机长期待机 | |
| C. | 离开房间时,随手关灯 | |
| D. | 使用高效节能型的用电设备 |
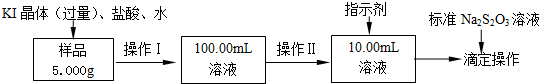
 吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下: