题目内容
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,11.2LCl2溶于水生成Cl-的数目为0.5NA
B.常温常压下,3.4g羟基(-OH)所含的电子数目为1.8NA
C.等物质的量的A1分别与足量盐酸和NaOH溶液反应,转移的电子数均为3NA
D.25℃时,1LpH=8的CH3COONa溶液中,水电离出的OH-数目为10-8NA
【答案】B
【解析】
A.标准状况下,11.2LCl2的物质的量为n=![]() =
=![]() =0.5mol,氯气与水反应生成盐酸和次氯酸,是可逆反应,故0.5mol氯气溶于水生成氯离子的数目小于0.5NA,故A错误;
=0.5mol,氯气与水反应生成盐酸和次氯酸,是可逆反应,故0.5mol氯气溶于水生成氯离子的数目小于0.5NA,故A错误;
B.3.4g羟基的物质的量为![]() =0.2mol, 0.2mol羟基含有0.2NA个羟基,一个羟基含有9个电子,电子数为0.2NA×9=1.8NA,故B正确;
=0.2mol, 0.2mol羟基含有0.2NA个羟基,一个羟基含有9个电子,电子数为0.2NA×9=1.8NA,故B正确;
C.由于铝的物质的量未知,故无法计算转移的电子数,故C错误;
D.根据水的离子积进行计算,c(OH)=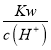 =
=![]() =106molL1,因此1L溶液水电离出的n(OH)=cV=106mol,醋酸钠溶液中的氢氧根离子全部来自水的电离,故水电离出的OH-数目为10-6NA, 故D错误;
=106molL1,因此1L溶液水电离出的n(OH)=cV=106mol,醋酸钠溶液中的氢氧根离子全部来自水的电离,故水电离出的OH-数目为10-6NA, 故D错误;
答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目