题目内容
【题目】下列有关电解质溶液的说法正确的是
A.同温度下,CH3COONH4溶液显中性,所以CH3COONH4不水解。
B.在室温下稀释两种酸时pH变化如图,其中HX为弱酸,且a点与b点的![]() 数值相同
数值相同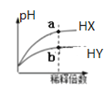
C.25℃时,等体积pH=3的HA和HB两种酸分别与足量的锌充分反应后,HA与Zn反应生成的氢气更多,HA是弱酸
D.若常温下,pH=3的HA溶液中水电离出的c(H+)为10-11mol·L-1,则能证明HA为弱酸。
【答案】C
【解析】
A. 同温度下,CH3COONH4溶液显中性,CH3COONH4为弱酸弱碱盐,其水溶液发生水解,A错误;
B. 在室温下稀释两种酸时pH变化如图,其中HY为弱酸,不能判断HX是否为弱酸,B错误;
C. 25℃时,等体积pH=3的HA和HB两种酸分别与足量的锌充分反应后,HA与Zn反应生成的氢气更多,则c(HA)>c(HB),HA溶液中存在未电离的分子,HA是弱酸,C正确;
D. 若常温下,pH=3的HA溶液中,水电离出的c(H+)为10-11mol·L-1,则不能证明HA是否为弱酸,D错误;
答案为C。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目