题目内容
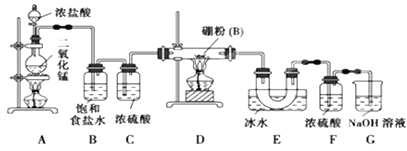
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )

A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
【答案】C
【解析】甲池能自发的发生氧化还原反应而作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N2H4-4e-+4OH-=N2+4H2O,正极反应为O2+4e-+2H2O=4OH-,乙池为电解池,阴极电极反应为 Cu2++2e-=Cu、阳极反应为4OH--4e-=2H2O+O2↑,A.通入肼的电极为负极,负极与阴极相连,银极为阴极,铜离子得电子生成铜单质,选项A错误;B.甲池负极反应为N2H4-4e-+4OH-=N2+4H2O,氢离子不能在碱性溶液中出现,选项B错误;C.甲池生成水,导致溶液中KOH浓度降低,则溶液pH减小,乙池中氢氧根离子放电,导致溶液pH减小,选项C正确;D.甲池N2H4-4e-+4OH-=N2+4H2O,消耗0.1mol N2H4时,转移0.4mol电子,乙池Cu2++2e-=Cu,产生0.2mol铜,为12.8g固体,选项D错误。答案选C。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
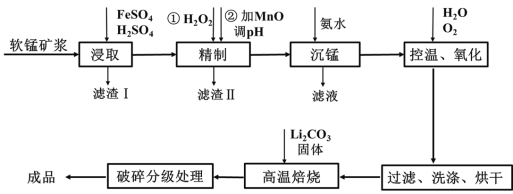
双基同步导航训练系列答案【题目】新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂的流程如图:
已知: lg2=0.3,![]() =8,25℃有关物质的溶度积常数:
=8,25℃有关物质的溶度积常数:
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 5.12×10-33 | 4.0×l0-14 |
(1)已知锂电池放电时正极的电极反应式为:LiMn2O4+e-+Li+ ===Li2Mn2O4,则锰酸锂中锰元素的化合价为____。
(2)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为_____,检验还含有Fe2+的方法是______。
(3)“精制”中加入H2O2的量比理论值大的多,其主要原因是______,若所得溶液中锰离子的浓度为1 mol·L-1,则加入氧化锰调节pH的范围为____(当溶液中离子浓度小于10-5 mol·L-1时可以认为沉淀完全)。
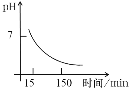
(4)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为Mn3O4,若控温氧化时溶液的pH随时间的变化如下图,则15~150 min内滤饼中一定参加反应的成分是______;判断的理由是____(用化学方程式表示)。
(5)写出高温煅烧生成锰酸锂的化学方程式_______。