题目内容
17.几种短周期元素的原子半径及主要化合价如表:| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | X的最高价氧化物的水化物碱性比Y的弱 | |
| B. | Y既可以和酸反应又可以和碱反应,且化合价变化相同 | |
| C. | 常温下,Z单质可以与L的氢化物溶液反应置换出L单质 | |
| D. | X、M分别与Q形成的化合物中所含化学键类型相同 |
分析 短周期元素中,Z、Q都有-2价,处于ⅥA族元素,Z有+6价,Q无正价,且Z的原子半径较大,则Z为S元素、Q为O元素;L元素有+7、-1价,故L为Cl元素;M有+4、-4价,处于ⅣA族,原子半径小于Cl,故M为C元素;X、Y化合价分别为+2、+3价,则分别处于ⅡA族、ⅢA族,且原子半径Z>Y>硫,故Z为Mg、Y为Al,据此解答.
解答 解:短周期元素中,Z、Q都有-2价,处于ⅥA族元素,Z有+6价,Q无正价,且Z的原子半径较大,则Z为S元素、Q为O元素;L元素有+7、-1价,故L为Cl元素;M有+4、-4价,处于ⅣA族,原子半径小于Cl,故M为C元素;X、Y化合价分别为+2、+3价,则分别处于ⅡA族、ⅢA族,且原子半径Z>Y>硫,故Z为Mg、Y为Al.
A.金属性Mg>Al,故碱性:氢氧化镁>氢氧化铝,故A错误;
B.Al与酸反应生成铝盐,与碱反应生成偏铝酸盐,反应中Al元素价变化相同,故B正确;
C.硫的氧化性比氯气若,常温下,硫单质不能与HCl溶液反应置换出氯气,故C错误;
D.X、M分别与Q形成的化合物分别为MgO、CO2(或CO),其中含有离子键,后者含有共价键,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,难度不大,根据化合价及原子半径推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
7.已知四种元素的原子半径如表所示:
根据表中数据推测磷元素的原子半径可能是( )
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A. | 0.80×10-10m | B. | 1.20×10-10m | C. | 1.10×10-10m | D. | 0.70×10-10m |
8.下列互为同素异形体的是( )
| A. | T与D | B. | 40K与40Ca | C. | 金刚石与石墨 | D. | 正丁烷与异丁烷 |
5.日本福岛第一核电站泄漏出微量的钚(Pu),下列关${\;}_{94}^{239}$Pu叙述正确的是( )
| A. | 质子数是94 | B. | 原子序数是239 | C. | 质量数是94 | D. | 中子数是239 |
12.短周期的A、B、C、D、E五种元素,原子序数依次增大.已知元素A的简单气态氢化物和它的最高价氧化物的水化物反应生成盐;B、E为同主族元素,且B元素原子最外层电子数是次外层的3倍; C是短周期中与水反应最激烈的金属元素;A、D最外层电子数相差2.下列说法错误的是( )
| A. | 原子半径:A>B | |
| B. | 失电子的能力:C<D | |
| C. | 简单气态氢化物的稳定性:B>E | |
| D. | 元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 |
2.有机物A和B只由C、H、O中的2种或3种元素组成,等物质的量的A与B分别完全燃烧时,消耗氧气的物质的量相等,则A与B相对分子质量之差(其中n为正数)不可能为( )
| A. | 8n | B. | 18n | C. | 14n | D. | 44n |
9.下列实验正确的是( )
| 实验名称 | 实验操作 | 实验现象 结论 | |
| A | 苯甲酸的重结晶 | ①加热溶解 ②趁热过滤 ③冷却结晶 | 将苯甲酸与溶性杂质分离 |
B | 溴乙烷法制乙烯并验证乙烯 | 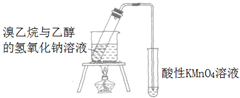 | 现象: KMnO4紫色褪去 结论: 证明有乙烯生成 |
C | 乙醇法制乙烯并验证乙烯 | 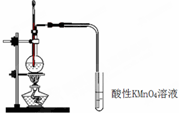 | 现象: KMnO4紫色褪去 结论: 证明有乙烯生 |
D | 验证乙酸、碳酸、苯酚溶液酸性强弱 | 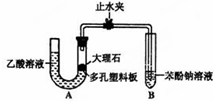 | 现象:A中大理石有气泡,B中溶液变浑浊 结论:酸性 乙酸强于碳酸强于苯酚 |
| A. | A | B. | B | C. | C | D. | D |
6.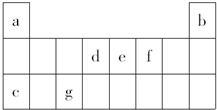 如表是元素周期表中的一部分,表中所列字母分别表示一种元素.(选项中的物质都由下表中的元素组成)由表中信息可推断下列说法正确的是( )
如表是元素周期表中的一部分,表中所列字母分别表示一种元素.(选项中的物质都由下表中的元素组成)由表中信息可推断下列说法正确的是( )
 如表是元素周期表中的一部分,表中所列字母分别表示一种元素.(选项中的物质都由下表中的元素组成)由表中信息可推断下列说法正确的是( )
如表是元素周期表中的一部分,表中所列字母分别表示一种元素.(选项中的物质都由下表中的元素组成)由表中信息可推断下列说法正确的是( )| A. | 宇航员在飞船活动舱内会产生d和f组成的气体,吸收这种气体的化合物应该由e和f组成 | |
| B. | 活动舱内还要营造一种适合宇航员生存的人工生态环境,即充入a和f的常见单质 | |
| C. | c和f以原子个数之比为1:1组成的化合物可用作宇航员所需f单质的来源 | |
| D. | 《阿凡达》中潘多拉星球上存在32b,地球上此元素主要以42b形式存在,32b比42b少一个质子 |
7.化学与生产生活息息相关,下列叙述正确的是( )
| A. | 次氯酸钠溶液作消毒剂,是因为钠盐能使蛋白质变性 | |
| B. | 工业电解熔融氧化铝冶炼铝,是因为氧化铝的成本比氯化铝低 | |
| C. | 生活中常用铁酱油、AD钙奶和钠盐,是因为铁、钙、碘都是人体必需元素 | |
| D. | 用硫化钠除去废水中的Hg2+、Cu2+,是因为硫化钠溶液是碱性,易生成氢氧化物沉淀 |