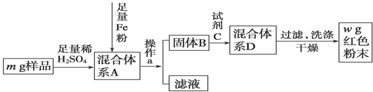
题目内容
2.CO是对环境影响较大的气体,对它的合理控制和治理是优化我们生存环境的有效途径.(1)工业上用CO和H2做原料可以合成甲醇,作为液体燃料.已知:
①2H2(g)+CO(g)+$\frac{3}{2}$O2(g)═2H2O(g)+CO2(g),△H1=-594.1kJ/mol
②2CH3OH(l)+3O2(g)═4H2O(g)+2CO2(g),△H2=-1452kJ/mol
请写出用CO(g)和H2(g)合成1mol液态甲醇的热化学反应方程式:2H2(g)+CO(g)=CH3OH(l)△HH H=+131.9 kJ/mol.
(2)一定温度下,在容积为2L的恒容容器中加入3mol H2和2mol CO,当反应2H2(g)+CO(g)?CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的0.6倍,据此计算该温度下反应的平衡常数(写出计算过程).
(3)在恒温恒容的条件下,向(2)达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡C.
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断是否移动.
分析 (1)根据盖斯定律结合热化学方程式计算所需热化学方程式;
(2)利用化学平衡三行式解答,设平衡时CO转化x mol•L-1;
2H2(g)+CO(g)?CH3OH(l)
起始时各物质浓度(mol•L-1 ) 1.5 1 0
变化浓度(mol/L) 2x x x
平衡时各物质浓度(mol•L-1 ) 1.5-2x 1-x x
依题意有达到平衡时,测得容器内的压强是反应前压强的$\frac{3}{5}$,1.5-2x+1-x+x=$\frac{3}{5}$×2.5,x=0.5,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
(3)利用Q与K的关系判断,Q=K,达到平衡,Q>K向逆向进行,Q<K向正向进行.
解答 解:(1)根据盖斯定律:①-②×$\frac{1}{2}$得CO(g)和H2(g)合成1mol液态甲醇的热化学反应方程式:2H2(g)+CO(g)=CH3OH(l)△H=+131.9 kJ/mol;
故答案为:2H2(g)+CO(g)=CH3OH(l)△H =+131.9 kJ/mol;
(2)设平衡时CO转化xmol•L-1;
2H2(g)+CO(g)?CH3OH(l)
起始时各物质浓度(mol•L-1 ) 1.5 1 0
变化浓度(mol/L) 2x x x
平衡时各物质浓度(mol•L-1 ) 1.5-2x 1-x x
依题意有达到平衡时,测得容器内的压强是反应前压强的$\frac{3}{5}$,1.5-2x+1-x+x=$\frac{3}{5}$×2.5,x=0.5,平衡常数K=$\frac{0.5}{0.{5}^{2}×0.5}$=4,
答:该温度下反应的平衡常数为4;
(3)该反应的平衡常数表达式为:K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$,在恒温恒容的条件下,向(2)达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则Q=$\frac{2c(C{H}_{3}OH)}{2c(CO)•{c}^{2}({H}_{2})}$=K,平衡不移动.
故答案为:C.
点评 本题考查了化学平衡计算应用,主要是平衡常数、转化率的计算,平衡移动原理和平衡影响因素分析是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 71g氯气通入足量水中,反应生成的HClO分子数为NA | |
| B. | 1mol硝基与NA个二氧化氮气体分子所含电子数相等 | |
| C. | 在反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2中,每生成1molO2该反应共转移的电子数为6NA | |
| D. | 1L 1mol/LAlCl3溶液中所含阳离子数小于NA |
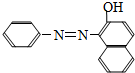 2005年2月,我国政府就含有添加“苏丹红一号“色素的食品可能诱发癌症发出警告,并全面清剿苏丹红.“苏丹红一号“结构简式如图.有关“苏丹红一号“的下列叙述中不正确的是 ( )
2005年2月,我国政府就含有添加“苏丹红一号“色素的食品可能诱发癌症发出警告,并全面清剿苏丹红.“苏丹红一号“结构简式如图.有关“苏丹红一号“的下列叙述中不正确的是 ( )| A. | 分子式为C16H12N2O | |
| B. | 能与浓溴水发生取代反应 | |
| C. | 能与氯化铁溶液作用使溶液呈紫色 | |
| D. | 因苏丹红一号中含有酚羟基,故可被空气氧化产生醛基 |
| A. | 天然蛋白质水解的最终产物均为氨基酸 | |
| B. | 油脂水解得到的醇是丙三醇 | |
| C. | 淀粉、纤维素、蛋白质和油脂都属于高分子化合物 | |
| D. | 淀粉、纤维素水解的产物都是葡萄糖 |