题目内容
7.V L硫酸铝溶液中含有m gAl3+,则溶液中SO42-的物质的量浓度是$\frac{m}{18V}$mol/L,硫酸铝的物质的量浓度是$\frac{m}{54V}$mol/L.分析 硫酸铝的化学式为Al2(SO4)3,根据n=$\frac{m}{M}$计算出mg 铝离子的物质的量,再根据c=$\frac{n}{V}$计算出铝离子的浓度,最后根据硫酸铝的化学式分别计算出硫酸铝、磷酸根离子的浓度.
解答 解:mg Al3+的物质的量为:n(Al3+)=$\frac{mg}{27g/mol}$=$\frac{m}{27}$mol,
铝离子的物质的量浓度为:c(Al3+)=$\frac{\frac{m}{27}mol}{VL}$=$\frac{m}{27V}$mol/L,
根据硫酸铝的化学式Al2(SO4)3可知,c(SO42-)=$\frac{3}{2}$c(Al3+)=$\frac{m}{27V}$mol/L×$\frac{3}{2}$=$\frac{m}{18V}$mol/L;
c[Al2(SO4)3]=$\frac{1}{2}$c(Al3+)=$\frac{m}{27V}$mol/L×$\frac{1}{2}$=$\frac{m}{54V}$mol/L,
故答案为:$\frac{m}{18V}$mol/L;$\frac{m}{54V}$mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答结构,注意掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
17.下图所示对实验仪器名称的标注或实验操作正确的是( )
| A. |  实验室制氯气 实验室制氯气 | B. | 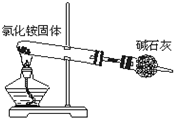 氨气的制取 氨气的制取 | ||
| C. | 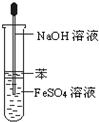 Fe(OH)2的制取 Fe(OH)2的制取 | D. |  浓硫酸的稀释 浓硫酸的稀释 |
15.下列有关热化学方程式的书写及对应的表述均正确的是( )
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
16.水是生命之源,也是最宝贵的资源之一.下列表述正确的是( )
| A. | 水是弱电解质 | B. | 4℃时,纯水的pH=7 | ||
| C. | 可燃冰是可以燃烧的水 | D. | 氢氧两种元素只能组成水 |
17.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液浓度和混合所得溶液的pH如表所示:
下列说法中,不正确的是( )
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合液的pH |
| ① | 0.2 | 0.1 | pH>7 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.1 | pH=9 |
| A. | 由实验①可知,HA为弱酸 | |
| B. | 实验①所得混合溶液:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 实验②所得混合溶液:c(Na+)=c(A-) | |
| D. | 实验③所得混合溶液中由水电离出的OH-的浓度为1×10-9mol•L-1 |
