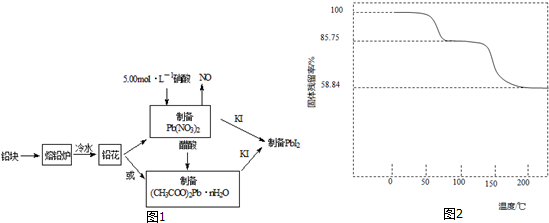
题目内容
14.现用质量分数为98%、密度为1.84g•cm-3的浓H2SO4来配制100mL2mol•L-1的稀H2SO4.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④药匙 ⑤量筒 ⑥容量瓶 ⑦托盘天平.请回答下列问题:(1)上述仪器中,在配制稀H2SO4时用不到的有②⑥⑦(填数字序号).配制时还欠缺的仪器是胶头滴管
(2)质量分数为98%、密度为1.84g•cm-3的浓H2SO4的物质的量浓度为18.4mol/L.2mol•L-1的稀H2SO4中c(QUOTE)=4mol/L.
(3)配制时需浓H2SO4的体积为10.9mL(保留小数点后1位).
(4)配制过程有以下操作:
A.移液 B.量取 C.洗涤 D.定容 E.溶解 F.摇匀
其正确的操作顺序应是BEACADF (填字母序号,步骤可以重复使用).
(5)在配制过程中,其它操作都准确,下列操作中,能引起误差偏低的有③⑤(填数字序号).
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②稀释后的H2SO4溶液未等冷却至室温就转移到容量瓶中
③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,仰视刻度线
(6)从上述容量瓶中移取25.00mL的稀硫酸溶液于100mL的容量瓶,加水稀释至刻度线.请问所得溶液中c(H+)=1mol/L.
分析 (1)根据配制一定物质的量浓度溶液的操作步骤选取实验仪器;
(2)根据物质的量浓度c=$\frac{1000ρω%}{M}$来计算;硫酸是二元强酸;
(3)设所需的浓硫酸的体积为VmL,根据稀释定律来计算;
(4)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来对操作步骤进行排序;
(5)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(6)根据稀释前后氢离子的物质的量不变来计算.
解答 解:(1)配制一定物质的量浓度硫酸溶液的一般步骤有:量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸溶液在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、量筒、胶头滴管、小烧杯、500ml容量瓶,所以用不到的仪器有烧瓶、托盘天平、药匙,还缺少的仪器为:胶头滴管;
故答案为:②⑥⑦;胶头滴管;
(2)溶液的物质的量浓度c=$\frac{1000ρω%}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L;由于硫酸是二元强酸,故2mol•L-1的稀H2SO4中c(H+)=4mol/L,
故答案为:18.4;4;
(3)设所需的浓硫酸的体积为VmL,根据稀释定律可知:100mL×2mol/L=18.4mol/L×VmL,解得V=10.9mL,故答案为:10.9;
(4)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是B E A C A D F,故答案为:B E A C A D F;
(5)①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,会导致溶质的量偏多,则浓度偏高,故①错误;
②稀释后的H2SO4溶液未等冷却至室温就转移到容量瓶中,则冷却后溶液体积偏小,浓度偏高,故②错误;
③定容摇匀后,发现液面低于标线是正常的,又用胶头滴管加蒸馏水至刻度线,则浓度偏低,故③正确;
④转移前,容量瓶中含有少量蒸馏,对浓度无影响,故④错误;
⑤定容时,仰视刻度线,则溶液体积偏大,浓度偏小,故⑤正确.
故选③⑤;
(6)容量瓶中硫酸的浓度为2mol/L,则氢离子的浓度为4mol/L,设稀释后氢离子浓度为xmol/L,则有:4mol/L×25mL=xmol/L×100mL,解得x=1mol/L,
故答案为:1mol/L.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉配制原理和过程是解题关键,转移容量瓶的选择和使用注意事项,注意误差的分析.

| A. | H+、Ca2+、NO3-、CO32- | B. | Fe3+、K+、OH-、SO42- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | K+、Na+、Cl-、NO3- |
回答下列问题:
| A | B | |
| C | D |
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.
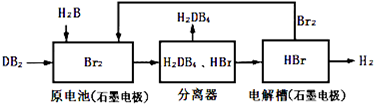
①查得:
| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
②根据资料:
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
③在原电池中,负极发生的反应式为SO2+2H2O-2e-=SO42-+4H+.
④在电解过程中,电解槽阴极附近溶液pH变大(填“变大”、“变小”或“不变”).
⑤将该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2+H2SO4.该生产工艺的优点有Br2被循环利用或能源循环供给或获得清洁能源(答一点即可).
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO${\;}_{3}^{-}$,其离子方程式为3 Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-(或3 Br2+3CO32-=5 Br-+BrO3-+3CO2↑).
| 硫酸盐 | 硝酸盐 | ||
| Na2SO4 | NaNO3 | ||
| 钙盐 | CaSO4 | Ca(NO3)2 | CaCO3 |
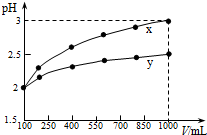
| A. | x为强酸,y为弱酸 | |
| B. | 稀释前x、y的物质的量浓度相等 | |
| C. | 随着稀释的进行,y的电离程度减小 | |
| D. | 等体积的x、y分别与足量的锌反应,y放出的氢气多 |