题目内容
12.用NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 71g氯气通入足量水中,反应生成的HClO分子数为NA | |
| B. | 1mol硝基与NA个二氧化氮气体分子所含电子数相等 | |
| C. | 在反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2中,每生成1molO2该反应共转移的电子数为6NA | |
| D. | 1L 1mol/LAlCl3溶液中所含阳离子数小于NA |
分析 A、氯气和水的反应为可逆反应;
B、硝基-NO2不带电荷;
C、反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2中,转移10mol电子时生成1mol氧气;
D、Al3+的水解导致溶液中的阳离子的个数增多.
解答 解:A、氯气和水的反应为可逆反应,不能进行彻底,故生成的次氯酸分子个数小于NA个,故A错误;
B、硝基-NO2不带电荷,故1mol硝基和NA个二氧化氮分子中均含23mol电子,故B正确;
C、反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2中,转移10mol电子时生成1mol氧气,即当生成1mol氧气时转移10mol电子即10NA个,故C错误;
D、Al3+的水解导致溶液中的阳离子的个数增多,故溶液中的阳离子的个数大于NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
3.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法不正确的是( )
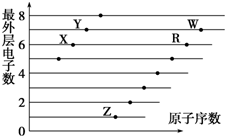

| A. | X和R在同一主族 | |
| B. | 含氧酸酸性:W>R | |
| C. | X与W可以形成酸性氧化物 | |
| D. | X、Z形成的化合物中可能含有共价键 |
20.某温度时,2NO(g)+O2(g)═2NO2(g)反应到2s后,NO的浓度减少了0.06mol•L-1,则以O2表示该时段的化学反应速率是( )
| A. | 0.03mol•L-1•s-1 | B. | 0.015mol•L-1•s-1 | ||
| C. | 0.12mol•L-1•s-1 | D. | 0.06mol•L-1•s-1 |
17.下图所示对实验仪器名称的标注或实验操作正确的是( )
| A. |  实验室制氯气 实验室制氯气 | B. | 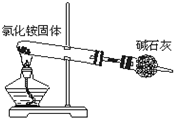 氨气的制取 氨气的制取 | ||
| C. | 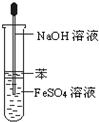 Fe(OH)2的制取 Fe(OH)2的制取 | D. |  浓硫酸的稀释 浓硫酸的稀释 |
4.下列各组离子能在溶液中大量共存的是( )
| A. | H+、Ca2+、NO3-、CO32- | B. | Fe3+、K+、OH-、SO42- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | K+、Na+、Cl-、NO3- |
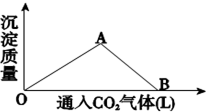 如图为一定量饱和 Ca(OH)2溶液中通入二氧化碳气体后,产生 CaCO3 白色沉淀的质量与二氧化碳体积之间的关系曲线.
如图为一定量饱和 Ca(OH)2溶液中通入二氧化碳气体后,产生 CaCO3 白色沉淀的质量与二氧化碳体积之间的关系曲线.