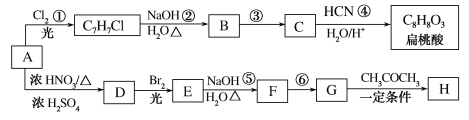
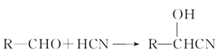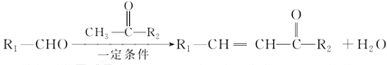题目内容
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A. 将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性
B. 向纯水中加入少量NaOH溶液,平衡逆向移动, KW变小
C. 向纯水中加入少量盐酸,平衡逆向移动,c(H+)增大,KW不变
D. 向纯水中加入醋酸钠,平衡正向移动,KW增大
【答案】C
【解析】
水的电离吸热,结合酸、碱、盐对是水电离平衡的影响以及影响水的离子积常数的因素分析解答。
A. 电离吸热,将纯水加热到95℃时促进水的电离,KW变大,氢离子浓度变大,pH减小,水仍呈中性,A错误;
B. 向纯水中加入少量NaOH溶液,氢氧根浓度增大,抑制水的电离,平衡逆向移动,温度不变,KW不变,B错误;
C. 向纯水中加入少量盐酸,氢离子浓度增大,抑制水的电离,平衡逆向移动,温度不变,KW不变,C正确;
D. 向纯水中加入醋酸钠,醋酸根水解,促进水的电离,平衡正向移动,温度不变,KW不变,D错误。
答案选C。

【题目】(1)恒温下,向一个2L的恒容密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示。
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/(mol·L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①前20min的平均速率ν(H2)为__________,该温度下此反应化学平衡平衡常数为_________。
②能提高反应中N2的平衡转化率的是___________。
A.增加N2的浓度 B.增加H2的量 C.移出部分NH3
D.提高反应温度 E.加入合适的催化剂
(2)工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
A、充入氦气增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
(3)已知某化学反应的平衡常数表达式为K=[CO2]·[H2]/[CO]·[H2O],在不同的温度下该反应的平衡常数如下表:
t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
该反应的化学方程是_________________________________;若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol,该反应__________达到平衡状态(填是或否)。
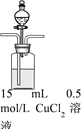
【题目】某兴趣小组欲探究SO2与Cu(OH)2 的反应。
实验 | 实验步骤 | 现象 |
| 步骤1:打开分液漏斗,向烧瓶中加入30mL 0.5 mol/LNaOH溶液 | I. 有蓝色絮状沉淀,静置后分层。 |
步骤2:从左侧导管通入SO2气体 | II. 静置后分层,上层溶液为淡绿色,底部有白色沉淀 |
(1)现象I中产生蓝色沉淀的离子方程式是___________。
(2)甲为了确认现象II中白色沉淀的成分,进行如下探究。查阅资料:
CuSO3 | CuCl | Cu2O | |
溶解性 | 不溶于水,浅黄色沉淀 | 不溶于水,白色沉淀 | 不溶于水,砖红色沉淀 |
性质 | 与酸反应 | 能溶于较浓的HCl溶液 | 酸性体系中不稳定,进一步反应生成Cu和Cu2+ |
并进行如下实验:
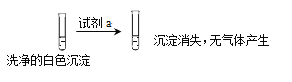
①试剂a是___________。
②现象II中生成白色沉淀的离子方程式是___________。
(3)甲认为Cu(OH)2沉淀全部转化为CuCl,乙依据实验现象对甲的观点进行反驳,依据的实验现象是_________。
(4)丙认为实验存在干扰,欲探究纯净的Cu(OH)2 悬浊液与SO2的反应。
①丙过滤I中的蓝色沉淀,洗涤,取最后一次洗涤液于试管中,_________(填操作和现象),证明已洗涤干净。再进行如下实验:
实验 | 实验步骤 | 现象 |
| 从左侧导管通入SO2气体 | III. 静置后分层,上层溶液为淡绿色,底部有砖红色沉淀。 |
②丙预测产物是Cu2O,取砖红色沉淀,洗涤后,_________(填操作和现象),证明产物是Cu2O。
(5)纯净的Cu(OH)2 悬浊液与SO2发生反应的化学方程式是_________。