题目内容
【题目】某兴趣小组欲探究SO2与Cu(OH)2 的反应。
实验 | 实验步骤 | 现象 |
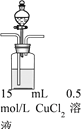
| 步骤1:打开分液漏斗,向烧瓶中加入30mL 0.5 mol/LNaOH溶液 | I. 有蓝色絮状沉淀,静置后分层。 |
步骤2:从左侧导管通入SO2气体 | II. 静置后分层,上层溶液为淡绿色,底部有白色沉淀 |
(1)现象I中产生蓝色沉淀的离子方程式是___________。
(2)甲为了确认现象II中白色沉淀的成分,进行如下探究。查阅资料:
CuSO3 | CuCl | Cu2O | |
溶解性 | 不溶于水,浅黄色沉淀 | 不溶于水,白色沉淀 | 不溶于水,砖红色沉淀 |
性质 | 与酸反应 | 能溶于较浓的HCl溶液 | 酸性体系中不稳定,进一步反应生成Cu和Cu2+ |
并进行如下实验:
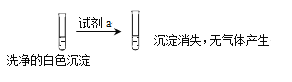
①试剂a是___________。
②现象II中生成白色沉淀的离子方程式是___________。
(3)甲认为Cu(OH)2沉淀全部转化为CuCl,乙依据实验现象对甲的观点进行反驳,依据的实验现象是_________。
(4)丙认为实验存在干扰,欲探究纯净的Cu(OH)2 悬浊液与SO2的反应。
①丙过滤I中的蓝色沉淀,洗涤,取最后一次洗涤液于试管中,_________(填操作和现象),证明已洗涤干净。再进行如下实验:
实验 | 实验步骤 | 现象 |
| 从左侧导管通入SO2气体 | III. 静置后分层,上层溶液为淡绿色,底部有砖红色沉淀。 |
②丙预测产物是Cu2O,取砖红色沉淀,洗涤后,_________(填操作和现象),证明产物是Cu2O。
(5)纯净的Cu(OH)2 悬浊液与SO2发生反应的化学方程式是_________。
【答案】Cu2++2OH-=Cu(OH)2↓ 浓HCl SO2+2Cu(OH)2+2Cl-=2CuCl+SO42-+2H2O 反应后上层为淡绿色溶液 滴加HNO3酸化的AgNO3溶液,无白色沉淀产生 加入适量H2SO4溶液,产生紫红色固体,溶液变蓝 3Cu(OH)2+SO2=Cu2O+CuSO4+3H2O
【解析】
(1)现象I中产生蓝色沉淀为氢氧化铜;
(2)由信息及实验操作可知,CuCl可溶于浓盐酸,无气体生成,可知二氧化硫与氯化铜发生氧化还原反应生成CuCl;
(3)上层溶液为淡绿色,可知铜离子剩余;
(4)①取最后一次洗涤液,检验氯离子不存在可说明洗涤干净;
②Cu2O在酸性体系中不稳定,进一步反应生成Cu和Cu2+;
(5)Cu(OH)2悬浊液与SO2发生反应生成Cu2O、CuSO4、水。
(1)现象I是NaOH与CuCl2发生复分解反应产生氢氧化铜沉淀也氯化钠,产生蓝色沉淀的离子方程式是Cu2++2OH-=Cu(OH)2↓;
(2)由信息及实验操作可知,CuCl可溶于浓盐酸,无气体生成,可知二氧化硫与氯化铜发生氧化还原反应生成CuCl,则试剂a是浓HCl,现象II中生成白色沉淀的离子方程式是SO2+2 Cu(OH)2+2Cl-=2CuCl+SO42-+2H2O;
(3)甲认为Cu(OH)2沉淀全部转化为CuCl,乙依据实验现象对甲的观点进行反驳,依据的实验现象是反应后上层为淡绿色溶液;
(4)①丙过滤I中的蓝色沉淀,洗涤,取最后一次洗涤液于试管中,滴加HNO3酸化的AgNO3溶液,无白色沉淀产生,证明已洗涤干净;
②丙预测产物是Cu2O,检验方法是:取砖红色沉淀,洗涤后,加入适量H2SO4溶液,产生紫红色固体,溶液变蓝;
(5)由(4)中实验现象可知,Cu(OH)2悬浊液与SO2发生反应的化学方程式是3Cu(OH)2+SO2=Cu2O+CuSO4+3H2O。