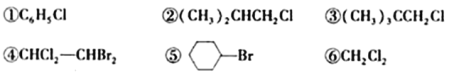
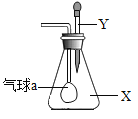
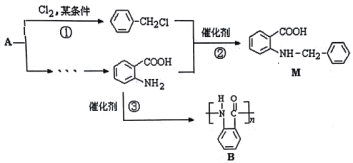
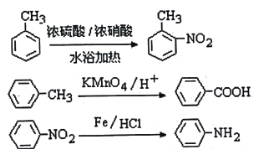
题目内容
【题目】钴的氧化物广泛应用于磁性材料及超导材料等领域。一种利用含钴废料(主要成分Co2O3,含少量Al2O3、MgO、SiO2等)制备Co2O3的工艺流程如下图所示。
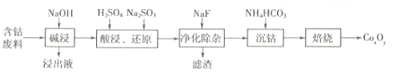
(1)“浸出液”的主要成分是________(写化学式)。
(2)“酸浸,还原”过程中溶解Co2O3的离子方程式为______________。稀硫酸和Na2SO3也可用盐酸替代,工业生产中不用盐酸的理由是_____________。
(3)NaF的作用是____________。
(4)“沉钴”时生成CoCO3的化学方程式为___________。检验CoCO3是否洗涤干净的操作方法是_______________。
(5)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为_____________。
【答案】NaAlO2、Na2SiO3Co2O3+SO32-+4H+=2Co2++SO42-+2H2O防止盐酸被Co203氧化为Cl2,污染环境除去镁离子CoSO4+2NH4HCO3=(NH4)2SO4+CoCO3↓+H2O+CO2↑取最后一次洗涤液少许于试管中,滴加盐酸Co3O4
【解析】
(1)Al2O3为两性氧化物,既可以与强酸反应也可以与强碱反应,SiO2可以与强碱反应,因此含钴废料经碱浸后,氧化铝与强碱反应生成偏铝酸钠,二氧化硅与氢氧化钠反应生成硅酸钠,因此“浸出液”的主要成分是NaAlO2、Na2SiO3;
(2)Co2O3与硫代硫酸根离子在酸性条件下发生氧化还原反应硫酸根离子、二价钴离子和水,离子方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;盐酸具有还原性还原产物有氯气,污染环境,因此工业上不用盐酸;
(3)氟离子与溶液中的镁离子结合成沉淀,经过滤除去镁离子;
(4)除杂后溶液中的主要成分是硫酸钴,硫酸钴与加入的碳酸氢氨反应生成硫酸铵、碳酸钴沉淀、二氧化碳和水,方程式为:CoSO4+2NH4HCO3=(NH4)2SO4+CoCO3↓+H2O+CO2↑;取最后一次洗涤液少许于试管中,滴加盐酸,如果没有气泡产生,则证明已经洗净;
(5)CO2的体积为1.344L(标准状况)的物质的量为1.344L÷22.4L/mol=0.06mol,由CoCO3的化学式可知n(Co)= n(C)=0.06mol,则m(Co)= n(Co)×M(Co)=0.06mol×59mol/g=3.54g,煅烧后固体中氧元素的物质的量为:n(O)= (4.82g-3.54g)÷16g/mol=0.08mol,则n(Co) :n(O)=0.06:0.08=3:4,因此灼烧后的化学式为Co3O4。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】根据表中信息,判断下列叙述中正确的是
序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① | Cl2 | FeBr2 | / | Cl- | |
② | KClO3 | 浓盐酸 | / | Cl2 | |
③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O