题目内容
【题目】下列条件下铁制品最容易生锈的是
A. 全浸在纯水中B. 半浸在盐水中
C. 露置在干燥空气中D. 半浸在有机溶剂溶液中
【答案】B
【解析】
铁在有水和氧气并存时最易生锈,根据铁生锈的条件进行分析。
A.全浸没在水中,铁与氧气不接触,不易生锈,A错误;
B.半浸在盐水中,既有水,也有氧气,且水中有食盐,铁制品的Fe、杂质碳与食盐水构成原电池,Fe作原电池的负极,失去电子被氧化,加快了Fe的腐蚀速率,最容易生锈,B正确;
C.在干燥的空气中铁与水接触的少,不易生锈,C错误;
D.半浸没在植物油中,铁与水不接触,只与氧气接触,不易生锈,D错误;
故合理选项是B。

【题目】下列实验事实得出的相应结论不正确的是
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色 | Ksp:AgCl>AgI |
C | 2NO2(g) | 加压平衡向着气体颜色加深的方向移动 |
D | 将MgCl2溶液蒸干后灼烧,得到MgO固体 | 蒸干的过程中水解生成的HCl挥发,水解进一步促进生成Mg(OH)2,灼烧后产生MgO |
A. A B. B C. C D. D
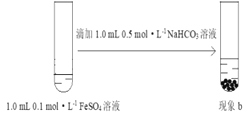
【题目】实验小组研究二价铁的还原性,设计如下实验。
序号 | 实验方案 | 现象 |
Ⅰ |
| 现象a:生成白色沉淀,3 min后沉淀基本变为红褐色 |
Ⅱ |
| 现象b:生成白色沉淀,3 min后沉淀颜色几乎不变 |
(1)实验所用的FeSO4溶液由Fe2(SO4)3溶液和足量铁粉反应制得,离子方程式是____。
(2)实验I中沉淀变为红褐色的化学方程式是________。
(3)关于实验II中白色沉淀的组成,小组同学展开研究。
① 已知Fe(HCO3)2在水中不存在。对沉淀组成作出如下假设,请补充完整。
假设a:依据NaHCO3溶液显_______性,推测白色沉淀可能为Fe(OH)2;
假设b:白色沉淀可能为_______。
② 研究白色沉淀组成的实验如下:
i.取少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量H2O2,溶液立即变为红色。
由此说明,白色沉淀中一定含有_________离子。
③ 研究过程中发现白色沉淀在空气中久置,最终变为红褐色。则该沉淀比实验I中所得的Fe(OH)2______(填“难”或“易”)于被空气氧化。
(4)对比实验I,研究酸碱性对二价铁还原性的影响,设计实验III:
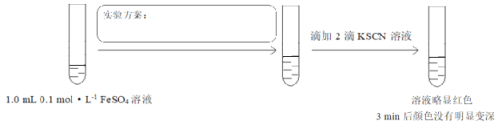
将实验方案补充完整______。
(5)据以上实验,为避免二价铁被空气氧化,可采取的措施是______。