��Ŀ����
18����ѧ�����ܵĵ��ԭ����Ӧ����Ҫ�����֣�һ���ȼҵ�����ǵ�⾫��ͭ�����ǵ��ұ�����й�����������ҵ��������������ȷ���ǣ�������| A�� | ��⾫��ͭʱ��������Ӧʽ��Cu2++2e-=Cu | |
| B�� | �ȼҵ�͵�⾫��ͭ�У��������������ӷŵ�ų����� | |
| C�� | ���ȼҵ�У������е�������������H2��NaOH�������������� | |
| D�� | ��⾫��ͭʱ��Ӧ�ô�ͭ����������ͭ��������������ͭ�����������Һ |
���� A����⾫��ͭʱ������������ͭ���ӵõ��ӵĻ�ԭ��Ӧ��
B���ȼҵ�У�������������ʧ���ӵ�������Ӧ����⾫��ͭ�У������ǽ���ʧ���ӵ�������Ӧ��
C���ڵ�ⱥ��NaCl��Һʱ��������Һ�����ӵķŵ�˳���жϲ��
D�����ݵ����ͭ��ԭ���Լ��缫��Ӧ���жϣ�
��� �⣺A����⾫��ͭʱ������������ͭ���ӵõ��ӵĻ�ԭ��Ӧ�������ڸ�������A����
B���ȼҵ�У�������������ʧ���ӵ�������Ӧ����⾫��ͭ�У������ǽ���ʧ���ӵ�������Ӧ�������ϵķ�Ӧ��ͬ����B����
C���ڵ�ⱥ��NaCl��Һ�У������е������������ӵõ��Ӳ���H2������ˮ�������������������������������������NaOH������������������C����
D����⾫��ͭʱ��Ӧ�ô�ͭ����������ͭ��������������ͭ�����������Һ����D��ȷ��
��ѡD��
���� ���⿼����ԭ������ȷ���ԭ�������ӵ��ƶ��������ӵķŵ�˳���ǽ����Ĺؼ�����Ŀ�ѶȲ���

��ϰ��ϵ�д�
 Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
�����Ŀ
15��������̬���Ļ���ﹲ1L���ڿ�������ȫȼ������1.5L CO2�����2Lˮ���������ڱ�״���²ⶨ�������ڸû�����˵����ȷ���ǣ�������
| A�� | һ���м��� | B�� | һ�������� | ||
| C�� | һ�����м��飬��һ���������� | D�� | �����Ǽ���ͱ���Ļ���� |
6����NAΪ�����ӏ�������ֵ������˵����ȷ���ǣ�������
| A�� | O.1molNa2O2��ˮ��Ӧת�Ƶ�����ĿΪ0.1NA | |
| B�� | ����£�2.24LCl2���µ��ӶԵ���ĿΪ0.2NA | |
| C�� | PH=2��H2SO4��Һ�к�H+����ĿΪ0.12NA | |
| D�� | ��10g��������Ϊ17%�İ�ˮ�У�����H����ĿΪ0.3NA |
3���������ö��Ե缫���1L������KCl����Һ����ͨ��n mol���ӵĵ���������Һ��pH��n�Ĺ�ϵ�ǣ�����ǰ����Һ��������䣬���ɵ�����ȫ���ݳ�����������
| A�� | pH=n | B�� | pH=-lg n | C�� | pH=14-lgn | D�� | pH=lgn+14 |
10����ͼ���ǿ��淴ӦX2+3Y2?2Z2�ڷ�Ӧ�����еķ�Ӧ���ʣ�v����ʱ�䣨t���Ĺ�ϵ���ߣ�����������ȷ���ǣ�������
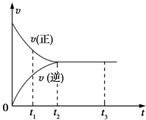

| A�� | t1ʱ��ֻ��������Ӧ | B�� | t1��t2��X2�����ʵ���Խ��Խ�� | ||
| C�� | t2��t3����Ӧ���ٷ��� | D�� | t2��t3�������ʵ�Ũ�Ȳ��ٷ����仯 |
7���ҹ����������ĺ�ú���ң����мӹ�����������ú���ۺ����õ��ǣ�������
| A�� | ���� | B�� | ���� | C�� | Һ�� | D�� | �ѽ� |
8�����й����л��������˵����ȷ���ǣ�������
| A�� | ���͵����ʶ��Ǹ߷��ӻ����ˮ�������ͬ | |
| B�� | ���ͼ�ϩ����ʹ��ˮ��ɫ��������ˮ�����ӳɷ�Ӧ | |
| C�� | ����̼��������Һ����������Ҵ� | |
| D�� | ����ˮ��ȥ�����л��е������������� |
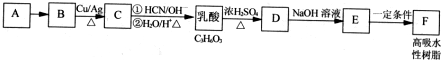

 ��
�� ��
��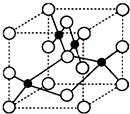 ��1��Cu2+����NH3��Cl-���γ���λ��Ϊ4��������֪[Cu��NH3��4]2+���жԳƵĿռ乹�ͣ�[Cu��NH3��4]2+�е�����NH3������Cl-ȡ�����ܵõ����ֲ�ͬ�ṹ�IJ����[Cu��NH3��4]2+�Ŀռ乹��Ϊƽ�������Σ�
��1��Cu2+����NH3��Cl-���γ���λ��Ϊ4��������֪[Cu��NH3��4]2+���жԳƵĿռ乹�ͣ�[Cu��NH3��4]2+�е�����NH3������Cl-ȡ�����ܵõ����ֲ�ͬ�ṹ�IJ����[Cu��NH3��4]2+�Ŀռ乹��Ϊƽ�������Σ�