题目内容
15.两种气态烃的混合物共1L,在空气中完全燃烧生成1.5L CO2气体和2L水蒸气(均在标准状况下测定).关于该混合物的说法正确的是( )| A. | 一定有甲烷 | B. | 一定有乙烷 | ||
| C. | 一定含有甲烷,不一定含有乙烷 | D. | 可能是甲烷和丙烷的混合物 |
分析 两种气态烃的混合物共1L,在空气中完全燃烧得到1.5L CO2、2L水蒸气,根据相同体积下气体的体积之比等于物质的量之比,据此可计算出混合烃的平均分子式为C1.5H4,利用平均值法对各选项进行判断.
解答 解:两种气态烃的混合物共1L,在空气中完全燃烧得到1.5L CO2、2L水蒸气,
根据n=$\frac{V}{{V}_{m}}$可知,相同条件下气体的物质的量与体积成正比,则混合烃的平均分子式为C1.5H4,
气态烃中不含碳原子为1.5的烃,所以混合气体分子组成肯定含有小于1.5和大于1.5的烃,小于1.5的烃只能为甲烷,故A正确;
由于甲烷含有4个H原子,混合烃中含有4个H原子,所以另一种也肯定含有4个H,可能为乙烯、丙炔等物质,一定不含乙烷和丙烷,故B、C、D错误;
故选A.
点评 本题考查了有机物分子组成的推断,题目难度中等,反应物和生成物之间体积关系确定气态烃的平均化学式,再利用平均化学式来分析解答,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
5.下列各图所示的气密性检查中,能说明装置漏气的是( )
| A. | 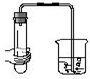 | B. | 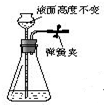 | C. |  | D. | 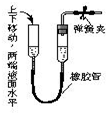 |
6.为了延长水果的保鲜期,下列的水果存放方法最合适的是( )
| A. | 放入敞口的容器中 | |
| B. | 放入浸泡过高锰酸钾溶液硅土的密封容器中 | |
| C. | 放入密封的容器中 | |
| D. | 放入充有少量乙烯的密封容器中 |
3.已知烯烃在一定条件下可以发生如下反应:2RCH=CHR′→RCH=CHR+R′CH=CHR′(R、R′都表示烃基)
该反应称为烯烃复分解反应,2005年诺贝尔化学奖就授予研究该反应的几位科学家.下列对该反应机理的猜测肯定不正确的是( )
该反应称为烯烃复分解反应,2005年诺贝尔化学奖就授予研究该反应的几位科学家.下列对该反应机理的猜测肯定不正确的是( )
| A. | 反应物分子都断裂C=C键 | |
| B. | 反应物分子都断裂R-C键 | |
| C. | 反应物分子都断裂R′-C键 | |
| D. | 两分子反应物中,一个断裂R-C键,另一个断裂R′-C键 |
10.下列实验操作或实验事故处理正确的是( )
| A. | 实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 | |
| B. | 实验室制硝基苯时,将硝酸与苯混合后再滴加浓硫酸 | |
| C. | 实验时手指上不小心沾上苯酚,立即用70℃以上的热水清洗 | |
| D. | 苯中含苯酚杂质,除去杂质的方法:加入溴水,过滤 |
20.2,2-二甲基对三联苯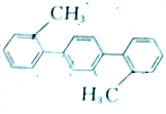 的一氯代物有(不考虑空间异构)( )
的一氯代物有(不考虑空间异构)( )
 的一氯代物有(不考虑空间异构)( )
的一氯代物有(不考虑空间异构)( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 14种 |
7.化合物M叫假蜜环菌素,它是香豆素类天然化合物.下列对M的叙述中错误( )
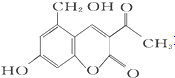 M(假蜜环菌素)
M(假蜜环菌素)
 M(假蜜环菌素)
M(假蜜环菌素)| A. | M的分子式为C12H10O5 | |
| B. | 1 mol M最多可和6mol H2发生加成反应 | |
| C. | M可发生水解反应 | |
| D. | M可与 HBr反应 |
4.依据下列实验现象,得出的结论正确的是( )
| 操作 | 实验现象 | 结论 | |
| A | 向NaBr溶液中加入氯水,再加入淀粉KI溶液 | 溶液变蓝 | 氧化性:Cl2>Br2>I2 |
| B | 将铝片放入盐酸中 | 产生气泡的速率开始较慢,随后加快,后来又逐渐减慢 | H+的浓度是影响反应速率的唯一因素 |
| C | 向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热 | 得到蓝色溶液 | 蔗糖水解产物没有还原性 |
| D | 向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液 | 品红溶液褪色 | 气体中含有Cl2 |
| A. | A | B. | B | C. | C | D. | D |
18.中学阶级介绍的电解原理的应用主要有三种:一是氯碱工业、二是电解精炼铜、三是电解冶金.下列关于这三个工业生产的描述中正确的是( )
| A. | 电解精炼铜时,负极反应式:Cu2++2e-=Cu | |
| B. | 氯碱工业和电解精炼铜中,阳极都是氯离子放电放出氯气 | |
| C. | 在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生 | |
| D. | 电解精炼铜时,应用粗铜作阳极、精铜作阴极,可溶性铜盐作电解质溶液 |