题目内容
17.下列实验能够达到目的是( )| A. | 用金属钠除去乙醇中混有的少量水 | |
| B. | 用湿润的蓝色石蕊试纸检验NH3 | |
| C. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| D. | 滴加数滴硫酸锌来加快铁与稀硫酸的反应 |
分析 A.Na与水、乙醇均反应;
B.检验氨气利用红色的石蕊试纸;
C.乙醇燃烧有淡蓝色的火焰,苯燃烧冒黑烟,而四氯化碳不能燃烧;
D.Fe不能置换出Zn,不能构成原电池.
解答 解:A.Na与水、乙醇均反应,不能利用Na除杂,应加CaO、蒸馏除杂,故A错误;
B.用湿润的红色石蕊试纸检验NH3,试纸变蓝即可检验,故B错误;
C.乙醇燃烧有淡蓝色的火焰,苯燃烧冒黑烟,而四氯化碳不能燃烧,则用燃烧法可鉴别乙醇、苯和四氯化碳,故C正确;
D.Fe不能置换出Zn,不能构成原电池,则不能加快反应速率,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、物质检验和鉴别、原电池及反应速率等,把握物质的性质、反应原理为解答的关键,注意实验的评价性分析,题目难度不大.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案
相关题目
7.下列反应,属于取代反应的是( )
①
②C2H5OH$→_{浓硫酸}^{170℃}$CH2=CH2↑+H2O
③CH3CH=CH2+Br2→CH3CHBrCH2Br
④CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
①

②C2H5OH$→_{浓硫酸}^{170℃}$CH2=CH2↑+H2O
③CH3CH=CH2+Br2→CH3CHBrCH2Br
④CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
| A. | ①② | B. | ③④ | C. | ①③ | D. | ①④ |
8.下列反应的离子方程式中,正确的是( )
| A. | 氢氧化钡溶液和稀硫酸Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 石灰乳与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 过量CO2通入NaOH溶液中CO2+2OH-=CO32-+H2O | |
| D. | 少量CO2通入NaOH溶液中CO2+OH-=HCO3-+H2O |
5.琥珀酸二乙酯的键线式结构如图所示;下列关于它的说法错误的是( )
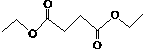

| A. | 该物质的化学式为C8H14O4 | |
| B. | 该物质不溶于水 | |
| C. | 琥珀酸是丁二酸 | |
| D. | 琥珀酸二乙酯与NaOH溶液反应,1 mol该物质可以得到2 mol乙醇和1 mol琥珀酸 |
2.25℃时,下列溶液中有关微粒的物质的量浓度关系错误的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子的浓度大小顺序为:c(Na+)=c(CHCOO-)>c(H+)=c(OH-) | |
| D. | pH=4的NaHA溶液:c(HA-)>c(H+)>c(H2A)>c(A2-) |
9.下列说法正确的是( )
| A. | 增加水的量或提高温度都可以加快镁和水的反应速率 | |
| B. | 增加硝酸的浓度可以加快锌与硝酸反应制氢气的速率 | |
| C. | 蒸干氯化铁溶液能够得到氯化铁固体 | |
| D. | 增加气态反应物的物质的量,未必增大其反应速率 |
6.在稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
| A. | 溶液中的SO42-向正极运动 | B. | 电子通过导线由铜片流向锌片 | ||
| C. | 正极有O2逸出 | D. | 铜片上有H2逸出 |
