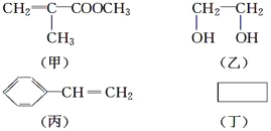题目内容
【题目】原子序数由小到大排列的五种短周期元素X、Y、Z、M、W,其中X是在周期表中原子半径最小的元素,Z 的最外层电子数是内层的3倍,Y、Z左右相邻,Z、W位于同主族,M与W同周期,且与X同主族。
(1)M元素是_______(填元素符号)。
(2)Z、W形成的气态氢化物中,较稳定的是_______(填化学式)。
(3)写出M2Z2的电子式:_______。
(4)由X、Y、Z、W四种元素中的三种组成的一种强酸,其稀溶液能与铜反应,离子方程式为_______。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知:
①1molA能与足量NaOH热的浓溶液反应生成标准状况下44.8L气体;
②A能与盐酸反应产生气体B,该气体能使品红溶液退色。
写出①中反应的化学方程式:_________。
【答案】Na H2O ![]() 3Cu+8H++2NO3- = 3Cu2++2NO+4H2O (NH4)2SO3+2NaOH=Na2SO3+2NH3+2H2O
3Cu+8H++2NO3- = 3Cu2++2NO+4H2O (NH4)2SO3+2NaOH=Na2SO3+2NH3+2H2O
【解析】
原子序数由小到大排列的五种短周期元素X、Y、Z、M、W,在周期表中X是原子半径最小的元素,则X为H元素;Z 的最外层电子数是内层的3倍,Z为O元素;Y、Z左右相邻,则Y为N元素;Z、W位于同主族,则W为S元素;M与W同周期,且与X同主族,则M为Na元素,据此分析解答。
根据上述分析,X为H元素,Y为N元素,Z为O元素,M为Na元素,W为S元素。
(1)根据上述分析可知,M为Na元素,故答案为:Na;
(2)非金属性O>S,故氢化物稳定性H2O>H2S,故答案为:H2O;
(3)Na2O2属于离子化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,该酸为HNO3,Cu与稀硝酸反应得到硝酸铜、NO与水,反应离子方程式为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,故答案为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑;
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,则A为铵盐。①1molA能与足量NaOH热的浓溶液反应生成标准状况下44.8L气体,为氨气,说明该铵盐中含有2个铵根离子;②A能与盐酸反应产生气体B,该气体能使品红溶液退色,说明该铵盐中含有亚硫酸根离子,则A为(NH4)2SO3,则A与氢氧化钠反应的化学方程式为(NH4)2SO3+2NaOH=Na2SO3+2NH3+2H2O,故答案为:(NH4)2SO3+2NaOH=Na2SO3+2NH3+2H2O。

【题目】下列根据实验事实得出的结论错误的是( )
实验事实 | 结论 | |
A. | 某溶液中加入BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
B. | 加热时,铜能与浓硫酸反应 | 浓硫酸有强氧化性 |
C. | 某分散系具有丁达尔效应 | 该分散系是胶体 |
D. | Al(OH)3既能与盐酸反应,也能与NaOH溶液反应 | Al(OH)3是两性氢氧化物 |
A.AB.BC.CD.D