题目内容
常温下,将v1 mL c1 mol·L-1的氨水逐滴滴加到v2 mL c2 mol·L-1的盐酸中,下列结论中正确的是( )。
| A.若v1=v2 c1=c2,则混合液中c(NH4+)=c(C1-) |
| B.若混合液的pH=7,则混合液中c(NH4+)>c(C1-) |
| C.若v1=v2且pH<7,则一定有c1<c2 |
| D.若混合液的pH=7,则c1v1>c2v2 |
D
试题分析:A、若v1=v2 c1=c2,刚好反应生成氯化铵,但是铵根离子会发生水解,则混合液中c(NH4+)<c(C1-),错误;B、若混合液的pH=7,则混合液中电荷守恒,可知:c(NH4+)=c(C1-),错误;C、若v1=v2且pH<7,则不一定有c1<c2,也可能是c1=c2,错误;D、正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
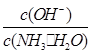 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。