题目内容
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)该实验应选用 作指示剂,量取一定体积的白醋所用的仪器是 。
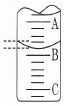
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。
(3)为了减小实验误差,该同学一共进行了3次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是( )
A.初读正确,实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗净,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)白醋溶液中存在的电离平衡为 (用电离平衡方程式表示)。
(5)在滴定过程中,当c(CH3COOˉ)>c(Na+)时,则混合溶液呈____(填序号)。
A.酸性 B.碱性 C.中性 D.无法确定
(6)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c= 。
(1)该实验应选用 作指示剂,量取一定体积的白醋所用的仪器是 。
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。

(3)为了减小实验误差,该同学一共进行了3次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是( )
A.初读正确,实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗净,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)白醋溶液中存在的电离平衡为 (用电离平衡方程式表示)。
(5)在滴定过程中,当c(CH3COOˉ)>c(Na+)时,则混合溶液呈____(填序号)。
A.酸性 B.碱性 C.中性 D.无法确定
(6)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c= 。
(10分)
(1)酚酞溶液(1分) 酸式滴定管(1分)
(2)25.40 (1分,答25.4不给分)
(3)BC(2分)(填写“B”或“C”给1分,填写“BC”给2分,其余均为0分)
(4)CH3COOH CH3COO——+H+、H2O
CH3COO——+H+、H2O OHˉ+H+(2分)
OHˉ+H+(2分)
(5)A(1分)
(6)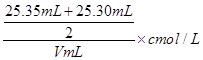
(1)酚酞溶液(1分) 酸式滴定管(1分)
(2)25.40 (1分,答25.4不给分)
(3)BC(2分)(填写“B”或“C”给1分,填写“BC”给2分,其余均为0分)
(4)CH3COOH
 CH3COO——+H+、H2O
CH3COO——+H+、H2O OHˉ+H+(2分)
OHˉ+H+(2分)(5)A(1分)
(6)
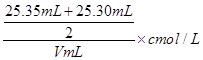
试题分析:(1)醋酸和NaOH恰好中和生成醋酸钠溶液呈碱性,因此选择变色△pH在碱性区间的酚酞作指示剂;醋酸溶液用酸式滴定管量取;(2)A、B、C分别为25.00mL、25.50mL、26.00mL,则液面读数为25.40mL;(3)A、滴定管的0刻度在上,滴定后俯视读数导致消耗NaOH溶液的体积偏低,错误;B、滴定前尖嘴无气泡,滴定后尖嘴有气泡,导致消耗NaOH溶液的体积偏高,正确;C、未用标准液润洗,残留蒸馏水能稀释标准液,消耗NaOH溶液的体积偏高,正确;D、未充分振荡,消耗NaOH溶液的体积偏小,错误;(4)醋酸和水都是部分电离的弱电解质,则CH3COOH
 CH3COO——+H+、H2O
CH3COO——+H+、H2O OHˉ+H+;(5)由电荷守恒原理可知,c(H+)>c(OH—),则溶液显酸性;(6)先舍去第一次实验数据,再求消耗NaOH溶液的平均体积,然后由c?V可知,n(NaOH)=cmol/L×
OHˉ+H+;(5)由电荷守恒原理可知,c(H+)>c(OH—),则溶液显酸性;(6)先舍去第一次实验数据,再求消耗NaOH溶液的平均体积,然后由c?V可知,n(NaOH)=cmol/L×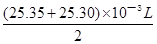 ;由CH3COOH+NaOH=CH3COONa+H2O可知,n(CH3COOH)=n(NaOH)=cmol/L×
;由CH3COOH+NaOH=CH3COONa+H2O可知,n(CH3COOH)=n(NaOH)=cmol/L×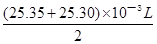 ;由n/V可知,则c(CH3COOH)=
;由n/V可知,则c(CH3COOH)=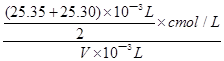 。
。
练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
 (NH4)2 SO4溶液中逐滴加入0.2000 mol
(NH4)2 SO4溶液中逐滴加入0.2000 mol