题目内容
3.已知烯烃在一定条件下可以发生如下反应:2RCH=CHR′→RCH=CHR+R′CH=CHR′(R、R′都表示烃基)该反应称为烯烃复分解反应,2005年诺贝尔化学奖就授予研究该反应的几位科学家.下列对该反应机理的猜测肯定不正确的是( )
| A. | 反应物分子都断裂C=C键 | |
| B. | 反应物分子都断裂R-C键 | |
| C. | 反应物分子都断裂R′-C键 | |
| D. | 两分子反应物中,一个断裂R-C键,另一个断裂R′-C键 |
分析 反应2RCH=CHR′→RCH=CHR+R′CH=CHR′类似于取代反应,两分子RCH=CHR′中,其中1个RCH=CHR′分子断裂R-C键,另一个RCH=CHR′分子断裂R′-C键;碳碳双键是否断裂则无法判断,据此进行解答.
解答 解:根据反应原理2RCH=CHR′→RCH=CHR+R′CH=CHR′可知,该反应类似于取代反应,反应过程中,1个RCH=CHR′分子断裂R-C键,另一个RCH=CHR′分子断裂R′-C键,故BC错误、D正确,
题中信息无法判断碳碳双键是否断裂,故A不一定错误,
所以一定不正确的为BC,
故选BC.
点评 本题考查探究反应原理,题目难度中等,根据反应原理正确分析反应中断键方式为解答关键,试题侧重考查学生的分析、理解能力及自学能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列叙述正确的是(( )
| A. | O2分子间存在着非极性共价键 | |
| B. | CO2分子内存在着极性共价键 | |
| C. | SO3与H2O反应的产物是离子化合物 | |
| D. | 盐酸中含有H+和Cl-,故HCl为离子化合物 |
14.0.1mol•L-1的下列几种溶液,其pH由大到小的顺序排列正确的是( )
①Na2CO3 ②CH3COONa ③NaCl ④NaHCO3 ⑤NH4Cl.
①Na2CO3 ②CH3COONa ③NaCl ④NaHCO3 ⑤NH4Cl.
| A. | ④>①>②>③>⑤ | B. | ②>①>④>③>⑤ | C. | ③>①>④>②>⑤ | D. | ①>④>②>③>⑤ |
11.下列说法正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 由共价键形成的一定是共价化合物分子 | |
| D. | 只有非金属原子间才能形成共价键 |
18.氢原子的电子云图中的小黑点表示的意义是( )
| A. | 一个小黑点表示一个电子 | B. | 黑点的多少表示电子个数的多少 | ||
| C. | 表示电子运动的轨迹 | D. | 电子在核外空间出现机会的多少 |
15.两种气态烃的混合物共1L,在空气中完全燃烧生成1.5L CO2气体和2L水蒸气(均在标准状况下测定).关于该混合物的说法正确的是( )
| A. | 一定有甲烷 | B. | 一定有乙烷 | ||
| C. | 一定含有甲烷,不一定含有乙烷 | D. | 可能是甲烷和丙烷的混合物 |
12.能在水溶液中大量共存的离子组是( )
| A. | H+、Fe3+、ClO-、Cl- | B. | H+、NH4+、Fe2+、NO3- | ||
| C. | Ag+、K+、Cl-、SO42- | D. | K+、AlO2-、Cl-、OH- |
6.设NA为阿伏加徳罗常数的值.下列说法正确的是( )
| A. | O.1molNa2O2与水反应转移电子数目为0.1NA | |
| B. | 标况下,2.24LCl2含孤电子对的数目为0.2NA | |
| C. | PH=2的H2SO4溶液中含H+的数目为0.12NA | |
| D. | 在10g质量分数为17%的氨水中,含有H的数目为0.3NA |
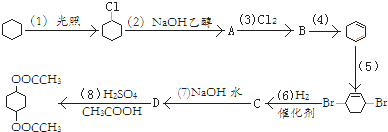
 ,取代反应
,取代反应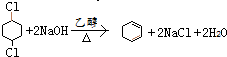 ,消去反应
,消去反应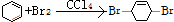 ,加成反应
,加成反应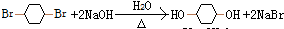 ,取代反应(水解反应)
,取代反应(水解反应)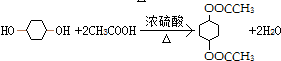 ,取代反应(酯化反应).
,取代反应(酯化反应).