题目内容
13.下列叙述正确的是(( )| A. | O2分子间存在着非极性共价键 | |
| B. | CO2分子内存在着极性共价键 | |
| C. | SO3与H2O反应的产物是离子化合物 | |
| D. | 盐酸中含有H+和Cl-,故HCl为离子化合物 |
分析 A、物质的分子间无任何化学键;
B、CO2分子内的共价键存在于C和O原子间;
C、SO3与H2O反应的产物是H2SO4;
D、由非金属元素形成的化合物绝大多数为共价化合物.
解答 解:A、物质的分子间无任何化学键,化学键存在于分子内,故A错误;
B、CO2分子的结构式为:O=C=O,共价键存在于C和O原子间,不同种原子间的共价键为极性共价键,故二氧化碳分子内的是极性共价键,故B正确;
C、SO3与H2O反应的产物是H2SO4,由非金属元素形成的化合物绝大多数为共价化合物,即H2SO4是共价化合物,故C错误;
D、由非金属元素形成的化合物绝大多数为共价化合物,故HCl是共价化合物,只是在溶液中共价键被破坏,所以电离为离子,故D错误.
故选B.
点评 本题考查了共价键、离子键的存在即判断,应注意的是化学键存在于分子内,物质的分子间无任何化学键,存在的是分子间作用力.

练习册系列答案
相关题目
3.铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2$\frac{\underline{\;高温\;}}{\;}$2PbO+2SO2;③制粗铅:PbO+C$\frac{\underline{\;高温\;}}{\;}$Pb+CO;PbO+CO$\frac{\underline{\;高温\;}}{\;}$Pb+CO2.下列说法正确的是( )
| A. | 浮选法富集方铅矿的过程属于化学变化 | |
| B. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| C. | 将1molPbS冶炼成Pb理论上至少需要6g碳 | |
| D. | 整个冶炼过程中,制取1molPb共转移2mol电子 |
4.下列说法中正确的是( )
| A. | 乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍 | |
| B. | NH4+中4个N-H键的键能不相同 | |
| C. | N-O键的极性比C-O键的极性小 | |
| D. | 球棍模型  表示二氧化碳分子,也可以表示二氧化氮分子 表示二氧化碳分子,也可以表示二氧化氮分子 |
18.在初中时我们就知道,有新物质生成的反应属于化学反应,但从化学键的观点看,化学反应的实质是“旧键的断裂,新键的形成”.据此你认为下列变化属于化学反应的是( )
| A. | 蔗糖溶于水 | B. | 金刚石变成石墨 | C. | 氯化钠熔化 | D. | 水的汽化 |
5.下列各图所示的气密性检查中,能说明装置漏气的是( )
| A. | 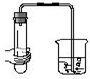 | B. | 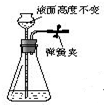 | C. |  | D. | 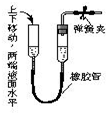 |
2.短周期元素离子aA2+、bB+、cC3+、dD- 都具有相同电子层结构,则下列叙述正确的是( )
| A. | 原子半径B>A>D | B. | 离子半径C>D>B>A | ||
| C. | 单质还原性A>B>D>C | D. | A、B、C、D可能是第二周期元素 |
3.已知烯烃在一定条件下可以发生如下反应:2RCH=CHR′→RCH=CHR+R′CH=CHR′(R、R′都表示烃基)
该反应称为烯烃复分解反应,2005年诺贝尔化学奖就授予研究该反应的几位科学家.下列对该反应机理的猜测肯定不正确的是( )
该反应称为烯烃复分解反应,2005年诺贝尔化学奖就授予研究该反应的几位科学家.下列对该反应机理的猜测肯定不正确的是( )
| A. | 反应物分子都断裂C=C键 | |
| B. | 反应物分子都断裂R-C键 | |
| C. | 反应物分子都断裂R′-C键 | |
| D. | 两分子反应物中,一个断裂R-C键,另一个断裂R′-C键 |