题目内容
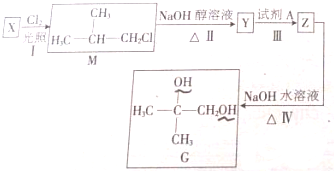
14.0.1mol•L-1的下列几种溶液,其pH由大到小的顺序排列正确的是( )①Na2CO3 ②CH3COONa ③NaCl ④NaHCO3 ⑤NH4Cl.
| A. | ④>①>②>③>⑤ | B. | ②>①>④>③>⑤ | C. | ③>①>④>②>⑤ | D. | ①>④>②>③>⑤ |
分析 根据溶液的酸碱性以及利用盐类的水解程度来确定溶液中pH大小,酸的酸性越弱则酸的酸根离子水解程度越大,其相同浓度钠盐溶液的pH越大.
解答 解:①碳酸钠溶液呈碱性,pH>7,相同浓度的碳酸钠和醋酸钠,碳酸钠的pH大于醋酸钠;
②醋酸钠是强碱弱酸盐,其溶液呈碱性,pH>7;
③氯化钠是强酸强碱盐,其溶液呈中性,pH=7;
④碳酸氢钠是强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度,导致其溶液呈碱性性,pH>7,与相同浓度的碳酸钠和醋酸钠溶液比较,溶液PH碳酸钠大于碳酸氢钠大于醋酸钠;
⑤氯化铵是强酸弱碱盐,铵根离子水解而使其溶液呈弱酸性,pH<7;
所以这几种溶液pH大小顺序是①>④>②>③>⑤,
故选D.
点评 本题考查了pH大小的判断,先根据溶液的酸碱性大体分类,再根据弱离子的水解浓度判断pH大小,注意碳酸氢根离子在水溶液里电离方式不同,题目难度中等.

练习册系列答案
相关题目
4.下列说法中正确的是( )
| A. | 乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍 | |
| B. | NH4+中4个N-H键的键能不相同 | |
| C. | N-O键的极性比C-O键的极性小 | |
| D. | 球棍模型  表示二氧化碳分子,也可以表示二氧化氮分子 表示二氧化碳分子,也可以表示二氧化氮分子 |
5.下列各图所示的气密性检查中,能说明装置漏气的是( )
| A. | 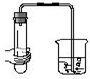 | B. | 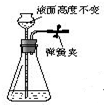 | C. |  | D. | 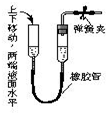 |
2.短周期元素离子aA2+、bB+、cC3+、dD- 都具有相同电子层结构,则下列叙述正确的是( )
| A. | 原子半径B>A>D | B. | 离子半径C>D>B>A | ||
| C. | 单质还原性A>B>D>C | D. | A、B、C、D可能是第二周期元素 |
19.已知化学反应2C(s)+O2(g)?2CO(g);2CO(g)+O2(g)?2CO2(g)都是放热反应.据此推断,下列说法不正确的是(其它条件相同)( )
| A. | 56g CO和32g O2所具有的总能量大于88g CO2所具有的总能量 | |
| B. | CO不如 CO2稳定 | |
| C. | 12g C所具有的能量一定高于28g CO所具有的能量 | |
| D. | 将一定质量的炭燃烧,生成CO2比生成CO时放出的热量多 |
6.为了延长水果的保鲜期,下列的水果存放方法最合适的是( )
| A. | 放入敞口的容器中 | |
| B. | 放入浸泡过高锰酸钾溶液硅土的密封容器中 | |
| C. | 放入密封的容器中 | |
| D. | 放入充有少量乙烯的密封容器中 |
3.已知烯烃在一定条件下可以发生如下反应:2RCH=CHR′→RCH=CHR+R′CH=CHR′(R、R′都表示烃基)
该反应称为烯烃复分解反应,2005年诺贝尔化学奖就授予研究该反应的几位科学家.下列对该反应机理的猜测肯定不正确的是( )
该反应称为烯烃复分解反应,2005年诺贝尔化学奖就授予研究该反应的几位科学家.下列对该反应机理的猜测肯定不正确的是( )
| A. | 反应物分子都断裂C=C键 | |
| B. | 反应物分子都断裂R-C键 | |
| C. | 反应物分子都断裂R′-C键 | |
| D. | 两分子反应物中,一个断裂R-C键,另一个断裂R′-C键 |
4.依据下列实验现象,得出的结论正确的是( )
| 操作 | 实验现象 | 结论 | |
| A | 向NaBr溶液中加入氯水,再加入淀粉KI溶液 | 溶液变蓝 | 氧化性:Cl2>Br2>I2 |
| B | 将铝片放入盐酸中 | 产生气泡的速率开始较慢,随后加快,后来又逐渐减慢 | H+的浓度是影响反应速率的唯一因素 |
| C | 向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热 | 得到蓝色溶液 | 蔗糖水解产物没有还原性 |
| D | 向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液 | 品红溶液褪色 | 气体中含有Cl2 |
| A. | A | B. | B | C. | C | D. | D |