题目内容
15.现有pH都等于1的盐酸和硫酸,及溶液的浓度都等于0.1mol•L-1的NaOH和Ba(OH)2溶液,四种溶液以等体积混合时,求所得溶液的pH.分析 pH都等于1的盐酸和硫酸溶液中c(H+)=0.1mol/L,浓度为0.1mol•L-1的NaOH中c(OH-)=0.1mol/L,0.1mol/L的Ba(OH)2溶液中c(OH-)=0.2mol/L,故将四种溶液等体积混合后,溶液中OH-过量,溶液显碱性.
设溶液的体积均为1L,则混合后c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$,然后求出c(H+)=$\frac{Kw}{c(O{H}^{-})}$,然后根据pH=-lgc(H+)来计算.
解答 解:pH都等于1的盐酸和硫酸溶液中c(H+)=0.1mol/L,浓度为0.1mol•L-1的NaOH中c(OH-)=0.1mol/L,0.1mol/L的Ba(OH)2溶液中c(OH-)=0.2mol/L,故将四种溶液等体积混合后,溶液中OH-过量,溶液显碱性.
设溶液的体积均为1L,则混合后c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$=$\frac{0.1mol/L×1L+0.2mol/L×1L-0.1mol/L×1L-0.1mol/L×1L}{4L}$=0.025mol/L,而c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.025}$mol/L=4×10-13mol/L,故pH=-lgc(H+)=12.4.
答:混合后溶液的pH为12.4.
点评 本题考查了酸碱混合后溶液pH的计算,题目难度中等,明确判断酸碱混合的定性判断及pH的计算方法为解答关键,注意掌握溶液pH的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
5.下列有关电解质的叙述中错误的是( )
| A. | 强电解质在水溶液里或熔融状态时的电离方式是一样的 | |
| B. | 弱电解质溶液可能比强电解质溶液的导电性强 | |
| C. | HCl是强电解质,它只能在水溶液里才能电离 | |
| D. | 电解质溶液导电过程中必然伴随化学变化 |
10.下列说法不正确的是( )
| A. | 等体积等浓度的Na2S溶液和Na2SO3溶液中,离子数目以前者为多 | |
| B. | 已知室温时0.10mol/L NH4Cl溶液中c(H+)=7.5×10-6mol/L,室温时0.10mol/L KCN溶液中c (OH-)=1.3×10-3mol/L.那么此时0.10mol/L NH4CN溶液中pH>7 | |
| C. | 等pH、等体积的醋酸和硫酸,分别与足量的碳酸氢钠反应,在相同条件下,硫酸放出气体更多 | |
| D. | 醋酸加到氢氧化钠溶液中,若要使所得溶液呈中性,醋酸应稍过量 |
20.某校实验小组的同学利用如图所示实验装置探究氨与氧化铜的反应(图中夹持、固定装置部分均略去).
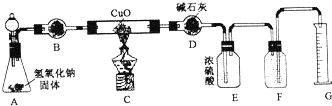
(1)按图设计组装好仪器,先检查装置的气密性,再装入药品.
(2)A中分液漏斗内应装浓氨水 B中固体试剂为碱石灰.
(3)打开分液漏斗活塞,加入试剂,点燃c处的酒精灯,一段时间后,观察到,A中氧化铜全部转化成光亮的红色固体,F中集气瓶内收集到一种无色气态单质.写出装置C中反应的化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O
(4)E中浓硫酸的作用是吸收未反应的氨气..
(5)已知Cu2O也是红色的.表为实验前后C装置的质量,通过计算可知反应后的产物中有(填“有’’、“无’’、“无法确定”)Cu2O.

(1)按图设计组装好仪器,先检查装置的气密性,再装入药品.
(2)A中分液漏斗内应装浓氨水 B中固体试剂为碱石灰.
(3)打开分液漏斗活塞,加入试剂,点燃c处的酒精灯,一段时间后,观察到,A中氧化铜全部转化成光亮的红色固体,F中集气瓶内收集到一种无色气态单质.写出装置C中反应的化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O
(4)E中浓硫酸的作用是吸收未反应的氨气..
(5)已知Cu2O也是红色的.表为实验前后C装置的质量,通过计算可知反应后的产物中有(填“有’’、“无’’、“无法确定”)Cu2O.
| 空玻璃管 | 实验前(样品+玻璃管) | 实验后(样品+玻璃管) |
| 59.60g | 65.60g | 64.64g |
7.下列叙述正确的是( )
| A. | 核素就是同位素 | |
| B. | 元素的金属性强弱与元素失去电子数的多少成正比 | |
| C. | 具有相同质子数的微粒一定是同一种元素 | |
| D. | 核内中子数为N的R2+,质量数为A,则该离子的核外电子数为A-N-2 |
4.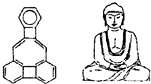 美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛.有关该有机分子的说法正确的是( )
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛.有关该有机分子的说法正确的是( )
 美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛.有关该有机分子的说法正确的是( )
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛.有关该有机分子的说法正确的是( )| A. | 该有机物属于芳香烃 | B. | 该有机物属于苯的同系物 | ||
| C. | 该有机物分子中含有23个碳原子 | D. | 该有机物的一氯代物有3种 |
5.下列离子方程式与所述事实相符且正确的是( )
| A. | 用食醋和淀粉-KI试纸检验碘盐中的KIO3:IO3-+5I-+6H+═3I2+3H2O | |
| B. | 稀HNO3溶液与难溶于水的FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | 碳酸氢钙与少量的NaOH溶液反应 Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | Na与水的反应Na+H2O═Na++OH-+H2↑ |
 土豪,原指地方上有钱有势的家族或个人、乡村中有钱的恶霸等,2013年土豪一词专指网络上无脑消费的人而成为流行语,将有望在2014年加入牛津词典.下图是土豪一词的拼音缩写,类似于某种有机物分子的键线式,若图中的线段可以表示单键或双键,请回答下列问题:
土豪,原指地方上有钱有势的家族或个人、乡村中有钱的恶霸等,2013年土豪一词专指网络上无脑消费的人而成为流行语,将有望在2014年加入牛津词典.下图是土豪一词的拼音缩写,类似于某种有机物分子的键线式,若图中的线段可以表示单键或双键,请回答下列问题: