题目内容
2.A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:(1)若Y为黄绿色气体:当 A、B的物质的量之比为1:6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:
 .
.(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1:2时,则A可能为铜、锌,检查其中刺激性气体产物X的方法是将气体通入品红溶液,能使溶液褪色.
(3)常温下A在B的浓溶液中会“钝化”,若A为金属单质,A和B以物质的量之比1:4反应,且A可溶于X溶液中.
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为0.3mol/L.
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1:1时,则被还原的X是0.4amol.
(4)若A、B、X、Y均为化合物.X为极易溶于水的气体,则盐A是铵盐,X极易溶于水的原因是:氨分子与水分子之间能形成氢键.
分析 (1)若Y是黄绿色气体,则Y为氯气,A、B的物质的量之比为1:6,则该反应为浓盐酸与氯酸钾反应来制取氯气;
(2)A为金属单质,B为无色油状黏稠液体,则该反应考虑为浓硫酸与金属的反应,当 A、B的物质的量之比为1:2时,则A应为+2价金属,刺激性气体产物X应为二氧化硫;
(3)常温下A在B的浓溶液中会“钝化”,A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水,X为3Fe(NO3)3,Y为NO;
(4)若A、B、X、Y均为化合物,X为极易溶于水的气体,则该 反应为铵盐与碱的反应,生成氨气极易溶于水,据此答题.
解答 解:(1)若Y是黄绿色气体,则Y为氯气,A、B的物质的量之比为1:6,则该反应为浓盐酸与氯酸钾反应来制取氯气,该反应的化学方程式,并用双线桥表示反应过程中的电子转移为 ,
,
故答案为: ;
;
(2)A为金属单质,B为无色油状黏稠液体,则该反应考虑为浓硫酸与金属的反应,当 A、B的物质的量之比为1:2时,则A应为+2价金属,则A能为铜、锌等,刺激性气体产物X应为二氧化硫,检验二氧化硫的方法为将气体通入品红溶液,能使溶液褪色,
故答案为:铜、锌;将气体通入品红溶液,能使溶液褪色;
(3)常温下A在B的浓溶液中会“钝化”,A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水,X为3Fe(NO3)3,Y为NO,
①过量的铁和100mL2mol/L的硝酸溶液即含硝酸0.2mol,充分反应后得到硝酸亚铁溶液,根据反应3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O可知,硝酸亚铁的物质的量为$\frac{3}{8}$×0.2mol=0.075mol,将溶液稀释至500mL后溶液中硝酯根离子的物质的量浓度为$\frac{0.075×2}{0.5}$mol/L=0.3mol/L,
故答案为:0.3mol/L;
②含 a mol Fe(NO3)3的溶液溶解了一定量Fe后,发生的反应为2Fe3++Fe═3Fe2+,设被还原的Fe(NO3)3是xmol,若溶液中两种金属阳离子的物质的量之比为1:1时,则有a-x=$\frac{3}{2}$x,x=0.4a,所以被还原的Fe(NO3)3是0.4amol,
故答案为:0.4a;
(4)若A、B、X、Y均为化合物,X为极易溶于水的气体,则 反应为铵盐与碱的反应,生成氨气极易溶于水,所以盐A是铵盐,氨气极易溶于水的原因是氨分子与水分子之间能形成氢键,
故答案为:铵;氨分子与水分子之间能形成氢键.
点评 本题考查无机物推断,属于开放性题目,需要学生熟练掌握元素化合物性质,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. |  向试管内加锌粒 | B. |  向试管内倒液体 | ||
| C. |  给试管内的液体加热 | D. |  用橡胶塞塞住试管 |
| A. | 结构示意图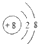 ,可以表示一种原子,也可以表示一种离子 ,可以表示一种原子,也可以表示一种离子 | |
| B. | 比例模型 可以表示二氧化碳分子,也可以表示二硫化碳分子分子 可以表示二氧化碳分子,也可以表示二硫化碳分子分子 | |
| C. | 电子式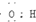 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| D. | 分子式C2H4O2:可以表示乙酸,也可以表示甲酸甲酯 |
| A. | 等体积等浓度的Na2S溶液和Na2SO3溶液中,离子数目以前者为多 | |
| B. | 已知室温时0.10mol/L NH4Cl溶液中c(H+)=7.5×10-6mol/L,室温时0.10mol/L KCN溶液中c (OH-)=1.3×10-3mol/L.那么此时0.10mol/L NH4CN溶液中pH>7 | |
| C. | 等pH、等体积的醋酸和硫酸,分别与足量的碳酸氢钠反应,在相同条件下,硫酸放出气体更多 | |
| D. | 醋酸加到氢氧化钠溶液中,若要使所得溶液呈中性,醋酸应稍过量 |
| A. | 将干燥的氯气与红色鲜花充分接触 | B. | 将H2 02加入到KMnO4溶液中 | ||
| C. | 将足量SO2通入紫色石蕊试液中 | D. | 将漂白液加入到Fe2(SO4)3溶液中 |
| A. | 核素就是同位素 | |
| B. | 元素的金属性强弱与元素失去电子数的多少成正比 | |
| C. | 具有相同质子数的微粒一定是同一种元素 | |
| D. | 核内中子数为N的R2+,质量数为A,则该离子的核外电子数为A-N-2 |
| A. | T2O与D2O | B. | 4019K与4020C | C. | O2和O3 | D. | 21H和31H |
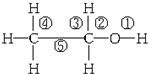
| A. | 乙醇与金属钠、乙酸、HBr的反应均是①处化学键断裂 | |
| B. | 乙醇燃烧时,①②③④⑤处化学键全部断裂 | |
| C. | 乙醇与浓硫酸170℃时反应,①③处化学键断裂 | |
| D. | 乙醇与氧化铜加热反应,①②③④⑤处化学键全部断裂 |
 .
.