题目内容
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
(1)所含铁元素既有氧化性又有还原性的物质是_______(用字母代号填).
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是_________nm.
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________________________.
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是__________,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,_________、__________(填实验操作)、干燥、称量沉淀质量为43.05g.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是________.
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+.
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+.
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
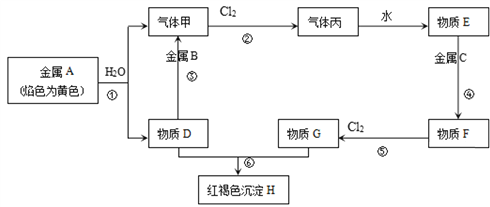
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
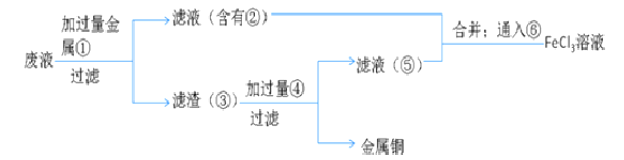
A.请写出上述实验中加入或生成的有关物质的化学式:
①__________;②_________;③__________;④___________.
B.请写出通入⑥的化学方程式_____________________________
【答案】C1-1002Fe3++ Cu==2Fe2+ +Cu2+Fe3+、Fe2+、Cu2+过滤洗涤BFeFeCl2Cu\FeHCl2FeCl2+Cl2==FeCl3
【解析】
(1)根据元素的化合价处于中间价态,既能升高,又能降低,既有氧化性又有还原性;(2)根据透明的红褐色是胶体,胶体的粒子直径1nm<d<100nm;(3)FeCl3溶液与铜反应:2Fe3++Cu═2Fe2++Cu2+; 滴入KSCN溶液呈红色,存在三价铁离子;(4)检验的Fe2+方法;(5)A、根据图示进行推断,金属是铁;B、亚铁离子氧化成三价铁离子。
(1)因元素的化合价处于中间价态时,既能升高,又能降低,既有氧化性又有还原性,FeSO4中Fe元素处于中间价态;答案选C;(2)因透明的红褐色是胶体,胶体的粒子直径1nm<d<100nm;(3)FeCl3中铁元素是+3价,最高价态,有氧化性,能被还原剂还原呈+2价,铜单质是0价最低价,具有还原性,能被氧化成+2价,所以方程式为:2FeCl3+Cu═CuCl2+2FeCl2;由于滴入KSCN溶液呈红色,证明溶液中Fe3+有剩余,溶液中含有的金属阳离子是:Fe3+、Fe2+、Cu2+;得到沉淀与溶液混合物后进行过滤、洗涤、干燥等,故取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、洗涤、干燥、称量沉淀质量为43.05g;(4)A、向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe3+,选项A错误;B、向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+;选项B正确;C、试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+,应该是先加入硫氰化钾,不变色,再加入氯水,若显示红色,证明有亚铁离子,选项C错误;答案选B;(5)A、制取的是氯化铁溶液,金属①是铁;滤液②是氯化亚铁溶液;加入的铁过量,滤渣③是铁和铜;制取的是氯化铁,溶解铁,④加入应该是盐酸;故答案为:Fe;FeCl2;Fe Cu;B、⑥是将亚铁离子氧化成三价铁离子,反应方程式是:2FeCl2+Cl2=2FeCl3。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做制冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
2H2(g)+CO(g)![]() CH3OH(g)△H=-90.0kJ·mol-1①
CH3OH(g)△H=-90.0kJ·mol-1①
2CH3OH(g)![]() CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.1kJ·mol-1③
CO2(g)+H2(g)△H=-41.1kJ·mol-1③
回答下列问题:
(1)新工艺的总反应3H2+3CO![]() CH3OCH3+CO2的热化学方程式为____________________。
CH3OCH3+CO2的热化学方程式为____________________。
(2)已知一些共价键的键能如下:
化学键 | H-H | C-H | C-O | O-H |
键能(kJ·mol-1) | 436 | 414 | 326 | 464 |
运用反应①计算一氧化碳中碳氧共价键的键能____________kJmol-1。
(3)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=____________。