题目内容
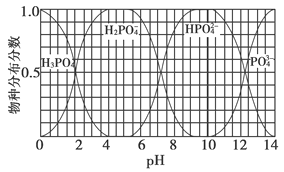
【题目】25℃时,往某酸的钠盐Na2A溶液中通入HCl,溶液中-lg![]() 和-lgc(HA-)或-lg
和-lgc(HA-)或-lg![]() 和-1gc(A2-)的关系如图所示。下列说法正确的是( )
和-1gc(A2-)的关系如图所示。下列说法正确的是( )
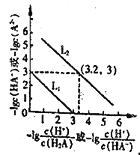
A. 直线L2表示-lg![]() 和-lgc(HA-)的关系
和-lgc(HA-)的关系
B. 通入HCl过程中,水电离的c(OH-)与水电离的c(H+)的乘积不断增大
C. c(H2A)的数量级为10-7
D. 在NaHA溶液中c(Na+)>(HA-)>c(H2A)>c(A2-)
【答案】D
【解析】A.H2A是二元弱酸,存在两步电离:H2A![]() HA-+H+,HA-
HA-+H+,HA-![]() A2-+H+,第2步电离受到第1步抑制,所以直线L2表示-lg
A2-+H+,第2步电离受到第1步抑制,所以直线L2表示-lg![]() 和-lgc(A2-)的关系;B. 温度不变,水的离子积为常数;C.根据图像变化可知,Ka1=10-6,Ka2=10-12;D. 已知:Ka1=10-6,Ka2=10-12;HA-发生水解反应的平衡常数Kh=Kw/Ka1=10-14/10-6=10-8, Ka2<Kh, 电离程度小于水解程度,比较溶液中离子浓度大小。
和-lgc(A2-)的关系;B. 温度不变,水的离子积为常数;C.根据图像变化可知,Ka1=10-6,Ka2=10-12;D. 已知:Ka1=10-6,Ka2=10-12;HA-发生水解反应的平衡常数Kh=Kw/Ka1=10-14/10-6=10-8, Ka2<Kh, 电离程度小于水解程度,比较溶液中离子浓度大小。
A项,H2A是二元弱酸,在溶液中发生两步电离:H2A![]() HA-+H+,HA-
HA-+H+,HA-![]() A2-+H+,Ka1=c(H+)×c(HA-)/c(H2A)、Ka2=c(H+)×c(A2-)/c(HA-),因为Ka1> Ka2,则-lgKa1<- lg Ka2,所以曲线L2表示-lg
A2-+H+,Ka1=c(H+)×c(HA-)/c(H2A)、Ka2=c(H+)×c(A2-)/c(HA-),因为Ka1> Ka2,则-lgKa1<- lg Ka2,所以曲线L2表示-lg![]() 和-lgc(A2-)的关系,A错误;通入HCl过程中,促进了Na2A溶液的水解,由于温度不变,水电离c(OH-)与水电离的c(H+)的乘积保持不变,B错误;曲线L2表示-lg
和-lgc(A2-)的关系,A错误;通入HCl过程中,促进了Na2A溶液的水解,由于温度不变,水电离c(OH-)与水电离的c(H+)的乘积保持不变,B错误;曲线L2表示-lg![]() 和-lgc(A2-)的关系,据图可知,则Ka2=10-6.2,K (H2A)的数量级为10-6,C错误;由上述分析可知,HA-发生电离的平衡常数Ka1=10-6、Ka2=10-12,HA-发生水解反应的平衡常数Kh=Kw/Ka1=10-14/10-6=10-8, Ka2<Kh, 电离程度小于水解程度,在NaHA溶液中c(Na+)>(HA-)>c(H2A)>c(A2-), D正确;正确选项D。
和-lgc(A2-)的关系,据图可知,则Ka2=10-6.2,K (H2A)的数量级为10-6,C错误;由上述分析可知,HA-发生电离的平衡常数Ka1=10-6、Ka2=10-12,HA-发生水解反应的平衡常数Kh=Kw/Ka1=10-14/10-6=10-8, Ka2<Kh, 电离程度小于水解程度,在NaHA溶液中c(Na+)>(HA-)>c(H2A)>c(A2-), D正确;正确选项D。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】在常温、常压和光照条件下,N2在催化剂表面与H2O发生反应:2N2(g)+6H2O(l) =4NH3(g)+3O2(g)。在2 L的密闭容器中,起始反应物用量相同,催化剂的使用情况也相同,控制不同温度分别进行4组实验,3 h后测定NH3的生成量,所得数据如下表:
实验级别 | 实验1 | 实验2 | 实验3 | 实验4 |
温度/K | 303 | 313 | 323 | 353 |
NH3生成量/106mol | 4.8 | 5.9 | 6.0 | 2.0 |
下列说法不正确的是
A. 温度为303 K时,在3 h内用氮气表示的平均反应速率为4×107mol·L1·h1
B. 实验1和实验3中,3 h内N2的转化率之比为4:5
C. 分析四组实验数据可得出,温度升高可加快反应速率,也可能减慢反应速率
D. 353 K时,可能是催化剂催化活性下降或部分水脱离催化剂表面,致使化学反应速率减慢
【题目】将一定量的氨基甲酸铵固体置于特制的密闭真空容器中(容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的部分平衡数据如下表:
2NH3(g)+CO2(g)。实验测得不同温度下的部分平衡数据如下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | p1 | 12.0 | p2 | 24.0 |
平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列说法中不正确的是
A. 混合气体的平均相对分子质量——M不再随时间变化时反应达平衡状态
B. 15.0 ℃时NH2COONH4(s)分解的平衡常数为2.0×10-9(mol/L)3
C. 该反应H>0,p2=2p1
D. 若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)均比原平衡大
【题目】二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做制冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
2H2(g)+CO(g)![]() CH3OH(g)△H=-90.0kJ·mol-1①
CH3OH(g)△H=-90.0kJ·mol-1①
2CH3OH(g)![]() CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.1kJ·mol-1③
CO2(g)+H2(g)△H=-41.1kJ·mol-1③
回答下列问题:
(1)新工艺的总反应3H2+3CO![]() CH3OCH3+CO2的热化学方程式为____________________。
CH3OCH3+CO2的热化学方程式为____________________。
(2)已知一些共价键的键能如下:
化学键 | H-H | C-H | C-O | O-H |
键能(kJ·mol-1) | 436 | 414 | 326 | 464 |
运用反应①计算一氧化碳中碳氧共价键的键能____________kJmol-1。
(3)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=____________。