题目内容
10.由铜、铁片和200mL硫酸铜溶液组成的原电池中,当铜片质量增加了12.8g,硫酸铜恰好全部作用完,回答下列问题:(1)铜片做正(填“正”或“负”)极,该电池反应式为Cu2++2e-=Cu.
(2)反应过程溶液中的硫酸根离子移向铁(填“铜”或“铁”)片,反应前后溶液的质量差为1.6克.
(3)假设反应前后溶液的体积不变,则反应后溶液的物质的量浓度是1mol/L.
分析 (1)原电池反应中负极是铁,电极反应为Fe-2e-=Fe2+;铜做正极,溶液中铜离子得到电子生成铜发生还原反应,电极反应Cu2++2e-=Cu;
(2)铜片质量增加了12.8g,转移电子物质的量为$\frac{12.8g}{64g/mol}$×2=0.4mol,有0.2molFe反应,据此计算溶液质量变化;
(3)反应后生成0.2mol硫酸亚铁,据c=$\frac{n}{V}$计算溶液浓度.
解答 解:(1)铜做正极,溶液中铜离子得到电子生成铜发生还原反应,电极反应Cu2++2e-=Cu,故答案为:正;Cu2++2e-=Cu;
(2)原电池中阴离子移向负极,所以硫酸根离子移向负极Fe,生成0.2molCu,有0.2molFe溶解,溶液质量减少0.2mol×64g/mol-0.2mol×56g/mol=1.6g,故答案为:铁;1.6;
(3)反应后硫酸亚铁的物质的量浓度为$\frac{0.2mol}{0.2L}$=1mol/L,故答案为:1mol/L.
点评 本题考查了原电池原理分析、电极反应书写计算的应用,掌握基础是关键,题目难度中等.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
18.下列各项表述正确的是( )
| A. | 羟基的电子式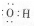 | B. | 醛基官能团符号-COH | ||
| C. | 乙醇的分子式:CH3CH2OH | D. | 异丁烷的结构简式:CH3CH(CH3)CH3 |
5.元素周期表和元素周期律对于其他与化学相关的科学技术有指导作用.下列说法中不正确的是( )
| A. | 在元素周期表左下方区域的金属元素中寻找半导体材料 | |
| B. | 利用元素周期表中氟、氯、硫、磷附近的元素研制新型农药 | |
| C. | 在过渡金属中寻找催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | 在周期表一定区域内寻找元素、发现物质的新用途是一种相当有效的方法 |
15.在烧杯中混合Ba(OH)2•8H2O与NH4Cl晶体,下列现象不能说明该反应是吸热反应的是( )
| A. | 有使湿润的pH试纸变蓝的气体产生 | |
| B. | 滴有水滴的玻璃片冻结在烧杯底部 | |
| C. | 盛有饱和硝酸钾溶液的试管置于反应混合物内,拿出后发现溶液浑浊 | |
| D. | 烧杯外壁有水珠凝结 |
13.下列四个图象所反映的内容与相应反应符合的是(a、b、c、d均大于0)( )
| A. | 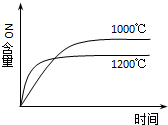 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 | |
| B. | 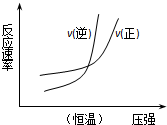 N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 | |
| C. | 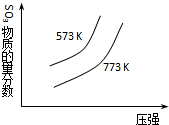 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 | |
| D. | 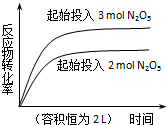 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 |
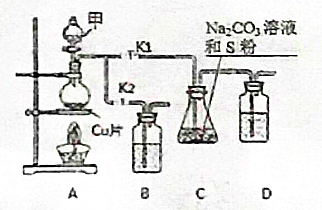 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.