题目内容
1.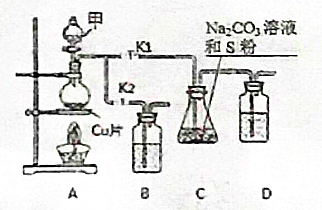 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.已知:Na2S2O3在酸性溶液中不能稳定存在.
步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量甲并加热,则试剂甲为:浓硫酸.
分析 由实验装置可知A用于制备二氧化硫,B为尾气处理装置,C中反应生成Na2S2O3,D为尾气处理装置,以此解答.
解答 解:A用于制备二氧化硫,应为浓硫酸和铜在加热条件下反应,则试剂甲为浓硫酸,故答案为:浓硫酸.
点评 本题考查物质的制备,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养.

练习册系列答案
相关题目
11.如图各装置不能达到实验目的是( )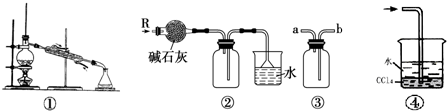

| A. | 装置①可用于由工业酒精制取无水酒精 | |
| B. | 装置②可用于干燥、收集氨气,并吸收多余的氨气 | |
| C. | 装置③可用于排空气法收集NO气体 | |
| D. | 装置④中下层物质若为四氯化碳,则可用于吸收氯化氢 |
12.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,23g NO2中含有NA个O原子 | |
| B. | 16g CH4中含有NA个C-H共价键 | |
| C. | 标准状态下,2.24L水中所含的分子数为0.1NA | |
| D. | 在0.1mol/L AlCl3溶液中所含的Cl- 的个数为0.3NA |
9.可逆反应4NH3(g)+5O2 (g)?4NO(g)+6H2O(g),下列叙述能说明反应已达平衡状态的是( )
| A. | 达到化学平衡时,υ正(NH3)=υ逆(H2O) | |
| B. | 达到化学平衡时,4υ (O2)=5υ (NO) | |
| C. | 若单位时间内生成x mol NO的同时,也消耗x mol NH3 | |
| D. | 若单位时间内生成4 mol NO的同时,也生成4 mol NH3 |
16.用NA表示阿伏伽德罗常数.下列叙述不正确的是( )
| A. | 由二氧化碳和氧气组成的混合气体共有NA个分子,其中氧原子数为2NA | |
| B. | 1mol铜与足量稀硝酸反应可产生NO分子$\frac{2}{3}$NA个. | |
| C. | 12g金刚石中含有共价键数为4NA | |
| D. | 1L1mol/L硫酸铝溶液中阴阳离子总数大于5NA. |
13.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1 的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由C2H4和C3H4 组成的混合气体中含有氢原子的数目为2NA |
