题目内容
5.元素周期表和元素周期律对于其他与化学相关的科学技术有指导作用.下列说法中不正确的是( )| A. | 在元素周期表左下方区域的金属元素中寻找半导体材料 | |
| B. | 利用元素周期表中氟、氯、硫、磷附近的元素研制新型农药 | |
| C. | 在过渡金属中寻找催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | 在周期表一定区域内寻找元素、发现物质的新用途是一种相当有效的方法 |
分析 A.在金属元素和非金属元素分界线附近,元素既有金属性也具有非金属性;
B.非金属元素F、Cl、S、P等可制备农药;
C.过渡元素中一些金属元素的化合物具有良好的催化作用;
D.由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质.
解答 解:A.在金属元素和非金属元素的分界线附近,元素既有金属性也具有非金属性所以可作半导体材料,故A错误;
B.非金属元素F、Cl、S、P等可制备农药,非金属元素在周期表的右上角,则用于制农药的元素通常位于周期表的右上角,故B正确;
C.过渡元素中一些元素的化合物具有良好的催化作用,则在过渡元素中可以找到新型催化剂,故C正确;
D.由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质,故D正确;
故选A.
点评 本题考查元素周期律,题目难度不大,熟悉元素在周期表中的位置及元素的性质即可解答,注重元素位置与性质的考查.

练习册系列答案
相关题目
15.除去溴苯中少量溴的方法是( )
| A. | 加入苯使之反应 | B. | 加入KI溶液 | ||
| C. | 加入较大量NaOH溶液后静置分液 | D. | 加入较大量的CCl4萃取静置后分液 |
16.用NA表示阿伏伽德罗常数.下列叙述不正确的是( )
| A. | 由二氧化碳和氧气组成的混合气体共有NA个分子,其中氧原子数为2NA | |
| B. | 1mol铜与足量稀硝酸反应可产生NO分子$\frac{2}{3}$NA个. | |
| C. | 12g金刚石中含有共价键数为4NA | |
| D. | 1L1mol/L硫酸铝溶液中阴阳离子总数大于5NA. |
13.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1 的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由C2H4和C3H4 组成的混合气体中含有氢原子的数目为2NA |
20.有关化学用语正确的是( )
| A. | 四氯化碳的电子式: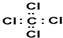 | B. | 氢氧根的电子式: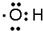 | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 乙醇的结构简式:CH3CH2OH |
17.下列物质中,不能用排水法收集的是( )
| A. | CO2 | B. | H2 | C. | C5H12 | D. | NO |
8.已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占有三种能量不同的原子轨道,且每种轨道中的电子总数相 同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外 电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
请回答下列问题(答题时,A、B、C、D、E用所对应元素符号表示):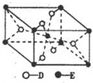
(1)A2D2分子的电子式为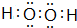 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.
(2)A、B、C、D四种元素中电负性大小顺序的是O>N>C>H.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a.M是极性分子,N是非极性分子 b.M和BD2分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键 d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
②已知:
Q(s)+2Cl2(g)═ECl4(l)+D2(g)△H=+140kJ•mol-1
2B(s)+D2(g)═2BD(g)△H=-221kJ•mol-1
写出物质Q和焦炭、氯气反应生成液态ECl4(l)和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:
C2(g)+3A2(g)═2CA3(g)△H<0,其化学平衡常数K与温度t的关系如下表.请回答下列问题.
①试比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 v(C2)正>v(C2)逆(填写“>”、“=”或“<”)
请回答下列问题(答题时,A、B、C、D、E用所对应元素符号表示):

(1)A2D2分子的电子式为
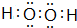 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.(2)A、B、C、D四种元素中电负性大小顺序的是O>N>C>H.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a.M是极性分子,N是非极性分子 b.M和BD2分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键 d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
②已知:
Q(s)+2Cl2(g)═ECl4(l)+D2(g)△H=+140kJ•mol-1
2B(s)+D2(g)═2BD(g)△H=-221kJ•mol-1
写出物质Q和焦炭、氯气反应生成液态ECl4(l)和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 v(C2)正>v(C2)逆(填写“>”、“=”或“<”)
9.下列物质与水发生反应,水既不是氧化剂又不是还原剂的是( )
| A. | 氯气 | B. | 过氧化钠 | C. | 氟气 | D. | 金属钾 |