题目内容
2.多少g氩气所含原子与32g氧气所含氧原子相等?分析 根据n=$\frac{m}{M}$=$\frac{N}{NA}$结合氩气为单原子分子的结构特点计算.
解答 解:设mg氩气所含原子与32g氧气所含氧原子相等,
则:$\frac{m}{40g/mol}$×1=$\frac{32g}{32g/mol}$×2,解得m=80g;
答:80g氩气所含原子与32g氧气所含氧原子相等.
点评 本题考查了有关物质的量的计算,注意把握相关计算公式的运用以及物质的构成特点是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,23g NO2中含有NA个O原子 | |
| B. | 16g CH4中含有NA个C-H共价键 | |
| C. | 标准状态下,2.24L水中所含的分子数为0.1NA | |
| D. | 在0.1mol/L AlCl3溶液中所含的Cl- 的个数为0.3NA |
13.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1 的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由C2H4和C3H4 组成的混合气体中含有氢原子的数目为2NA |
17.下列物质中,不能用排水法收集的是( )
| A. | CO2 | B. | H2 | C. | C5H12 | D. | NO |
8.已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占有三种能量不同的原子轨道,且每种轨道中的电子总数相 同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外 电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
请回答下列问题(答题时,A、B、C、D、E用所对应元素符号表示):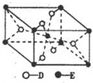
(1)A2D2分子的电子式为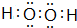 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.
(2)A、B、C、D四种元素中电负性大小顺序的是O>N>C>H.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a.M是极性分子,N是非极性分子 b.M和BD2分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键 d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
②已知:
Q(s)+2Cl2(g)═ECl4(l)+D2(g)△H=+140kJ•mol-1
2B(s)+D2(g)═2BD(g)△H=-221kJ•mol-1
写出物质Q和焦炭、氯气反应生成液态ECl4(l)和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:
C2(g)+3A2(g)═2CA3(g)△H<0,其化学平衡常数K与温度t的关系如下表.请回答下列问题.
①试比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 v(C2)正>v(C2)逆(填写“>”、“=”或“<”)
请回答下列问题(答题时,A、B、C、D、E用所对应元素符号表示):

(1)A2D2分子的电子式为
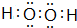 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.(2)A、B、C、D四种元素中电负性大小顺序的是O>N>C>H.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a.M是极性分子,N是非极性分子 b.M和BD2分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键 d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
②已知:
Q(s)+2Cl2(g)═ECl4(l)+D2(g)△H=+140kJ•mol-1
2B(s)+D2(g)═2BD(g)△H=-221kJ•mol-1
写出物质Q和焦炭、氯气反应生成液态ECl4(l)和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 v(C2)正>v(C2)逆(填写“>”、“=”或“<”)
6.某有机物A的结构为CH3-CH=CH-CH2OH,它不可能发生的反应是( )
| A. | 与氢氧化钠溶液反应 | B. | 使溴的四氯化碳溶液褪色 | ||
| C. | 与金属钠反应放出氢气 | D. | 使高锰酸钾溶液褪色 |
