题目内容
2.化合物X2Y由短周期元素X和Y组成.下列说法一定正确的是( )| A. | X的原子半径大于Y | |
| B. | 若X为ⅠA族元素,则该化合物中含离子键 | |
| C. | 若X2Y的焰色为黄色,则它的电子式是 | |
| D. | 若每个X2Y分子中含有10个电子,则Y是第3周期元素 |
分析 短周期中的X和Y两种元素可组成化合物X2Y,当X、Y的化合价可以分别为+1、-2价时,X处于IA族、Y处于ⅥA族,也可以为其它化合物,若N2O、Cl2O等.
A.若X为H元素,其原子半径在所有元素中最小;
B.若X为ⅠA族元素,该化合物可能为H2O等;
C.若X2Y的焰色为黄色,则X为Na,Y为O或硫;
D.若每个X2Y分子中含有10个电子,则X为H、Y为O.
解答 解:短周期中的X和Y两种元素可组成化合物X2Y,当X、Y的化合价可以分别为+1、-2价时,X处于IA族、Y处于ⅥA族,也可以为其它化合物,若N2O、Cl2O等.
A.若X为H元素,其原子半径在所有元素中最小,故A错误;
B.若X为ⅠA族元素,该化合物可以为氧化钠,属于离子化合物,该化合物可能为H2O等,属于共价化合物,故B错误;
C.若X2Y的焰色为黄色,则X为Na,Y为O或硫,电子式为 ,故C正确;
,故C正确;
D.若每个X2Y分子中含有10个电子,则X为H、Y为O,Y元素不可能处于第三周期,故D错误,
故选C.
点评 本题考查结构性质位置关系应用,注意根据可能的化合价判断元素在周期表的位置,注意结合常见化合物判断其它可能的情况,难度中等.

练习册系列答案
相关题目
13.常温下,下列各溶液中,酸性最强的是( )
| A. | pH=3 | B. | c(H+)=5×10-5mol/L | ||
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=6 | D. | c(OH-)=10-12mol/L的溶液 |
10.常温下,若将pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
| A. | 生成了一种强酸弱碱盐 | B. | 弱酸溶液和强碱溶液反应 | ||
| C. | 强酸溶液和弱碱溶液反应 | D. | 一元强酸溶液和一元强碱溶液 |
14.如表是不同温度下水的离子积数据:
若25<t1<t2,则α>(填“<”“>”或“=”)1×10-14.
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
11.X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )
| A. | 非金属性:Y>Z | |
| B. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
12.下列方程式表示的反应既不属于加成反应也不属于取代反应的是( )
| A. | C6H5CH2Cl+NaCN→C6H5CH2CN+NaCl | |
| B. | C6H5Li+CO2→C6H5COOLi | |
| C. | CH3CH2CHO+HCN$\stackrel{NaOH}{→}$ | |
| D. | CH3COOCH2CH3$→_{气相}^{450℃}$CH3COOH+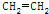 |

 .
. ⑧
⑧