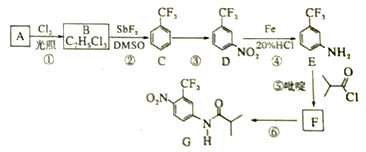
题目内容
【题目】向某密闭容器中充入NO2,发生反应2NO2(g)![]() N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
t/℃ | 27 | 35 | 49 | 70 |
NO2% | 20 | 25 | 40 | 66 |
N2O4% | 80 | 75 | 60 | 34 |
下列说法不正确的是( )
A.27℃,该平衡体系中的NO2转化率为![]()
B.平衡时,NO2的消耗速率为N2O4消耗速率的2 倍
C.室温时,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅
D.其他条件不变,增大NO2起始量,平衡正移,该反应的化学平衡常数增大
【答案】D
【解析】
由表中数据可知升高温度,NO2物质的量分数增大,N2O4物质的量分数减小,则平衡逆向移动,正反应为放热反应。
A.27℃时,该平衡体系中NO2的物质的量分数为20%,N2O4的物质的量分数为80%,设物质的量分别为0.2mol、0.8mol,由方程式2NO2(g)![]() N2O4(g)可知,转化NO2的物质的量为1.6mol,则该平衡体系中NO2的转化率为
N2O4(g)可知,转化NO2的物质的量为1.6mol,则该平衡体系中NO2的转化率为![]() =
=![]() ,故A正确;
,故A正确;
B.速率比值等于化学计量数之比,平衡时,正逆反应速率相等,则平衡时,NO2的消耗速率为N2O4消耗速率的2倍,故B正确;
C.正反应为放热反应,则降低温度,平衡正向移动,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅,故C正确;
D.平衡常数只受温度的影响,温度不变,平衡常数不变,故D错误;
故答案为D。

练习册系列答案
相关题目