题目内容
【题目】羟胺的电离方程式为:NH2OH+H2O![]() NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL 0.lmol/L羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL 0.lmol/L羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
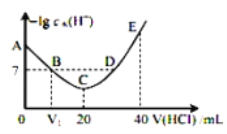
A.图中V1<10
B.A点对应溶液的pH=9.5
C.A、B、C、D四点中酸性最强的点为D点
D.E点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
【答案】D
【解析】
A.羟胺是一元弱碱,若V1=10,则反应恰好起始时产生等量的NH2OH和NH3OH+,NH3OH+的水解常数![]() =1.1×10-5比NH2OH电离常数9.0×10-9大,溶液呈酸性,B点时水的电离达到10-7mol/L,则羟胺过量,需要少滴加一部分HCl,所以V1应<10,故A正确;
=1.1×10-5比NH2OH电离常数9.0×10-9大,溶液呈酸性,B点时水的电离达到10-7mol/L,则羟胺过量,需要少滴加一部分HCl,所以V1应<10,故A正确;
B.羟胺的电离方程式为:NH2OH+H2ONH3OH++OH-,已知25℃时,其电离平衡常数为Kb=9.0×l0-9,起始浓度为c0=0.1mol/L,溶液中c(OH-)=![]() =
=![]() =3.0×10-5mol/L,c(OH-)=
=3.0×10-5mol/L,c(OH-)=![]() mol/L=
mol/L=![]() ×10-9mol/L,pH=-lg
×10-9mol/L,pH=-lg![]() ×10-9mol=9+lg3=9.5,故B正确;
×10-9mol=9+lg3=9.5,故B正确;
C.C点溶液中水电离生成的氢离子最大,则C点盐酸与羟胺恰好完全反应产生NH3OHCl,C点以后HCl过量,所以D点酸性最强,溶液呈酸性,故C正确;
D.E点时加入HCl的体积为40mL,根据电荷守恒:c(H+)+c(NH3OH+)=c(OH-)+c(Cl-),根据物料守恒:2c(NH3OH+)+2c(NH2OH)=c(Cl-),则有c(H+)=c(OH-)+c(NH3OH+)+2c(NH2OH),故D错误;
故答案为D。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案【题目】向某密闭容器中充入NO2,发生反应2NO2(g)![]() N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
t/℃ | 27 | 35 | 49 | 70 |
NO2% | 20 | 25 | 40 | 66 |
N2O4% | 80 | 75 | 60 | 34 |
下列说法不正确的是( )
A.27℃,该平衡体系中的NO2转化率为![]()
B.平衡时,NO2的消耗速率为N2O4消耗速率的2 倍
C.室温时,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅
D.其他条件不变,增大NO2起始量,平衡正移,该反应的化学平衡常数增大